
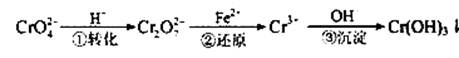
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)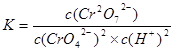 ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g) △H>0。在850℃时,K=1。?此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
CO2(g)+H2(g) △H>0。在850℃时,K=1。?此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.不能确定有无AgI沉淀生成 | B.没有AgI沉淀生成 |
| C.有KNO3晶体析出 | D.有AgI沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
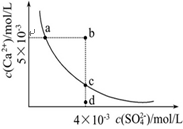
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止 |
| B.Ksp越小,难溶电解质在水中的溶解能力一定越弱 |
| C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关 |
| D.相同温度下, AgCl在水中的溶解能力与在NaCl溶液中的相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
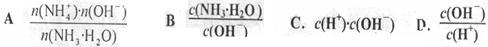
 4)将________。
4)将________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.难 溶电解质的溶度积Ksp越小,则它的溶解度越小? 溶电解质的溶度积Ksp越小,则它的溶解度越小? |
| B.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示? |
| C.溶度积常数Ksp与温度有关,温度越高,溶度积越大? |
| D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com