
【题目】关于下列装置说法正确的是( )
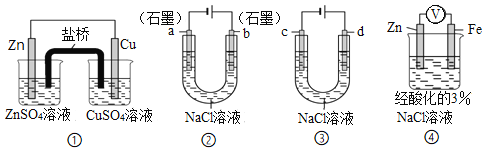
A. 装置①中,盐桥中的Cl-移向CuSO4溶液
B. 装置②工作一段时间后,a极附近溶液的pH降低
C. 用装置③精炼铜时,c极为粗铜
D. 装置④中电子由Zn流向Fe,Zn极发生氧化反应
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应: 2SO2(g)+O2(g)![]() 2SO3(g)。当SO2、O2、 SO3的浓度不再变化时,下列说法正确的是
2SO3(g)。当SO2、O2、 SO3的浓度不再变化时,下列说法正确的是
A. SO2和O2全部转化为SO3
B. 正、逆反应速率相等且等于零
C. 该反应已达化学平衡状态
D. SO2、 O2、SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
A. 硫酸、CuSO45H2O,苛性钾
B. 硫酸、空气、纯碱
C. 氧化铁、胆矾、熟石灰
D. 硝酸、食盐水、烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-542.7kJ/mol
B. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1059.3kJ/mol
C. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7kJ/mol
D. N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g) ΔH=-1076.7kJ/mol
N2(g)+2H2O(g) ΔH=-1076.7kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )

A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c), v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)<M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。

(1)写出甲中正极的电极反应式:____。
(2)乙中负极为__,总反应的离子方程式:___。
(3)由此实验得出的下列结论中,正确的有____。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
Ⅱ.化学电池在通信、交通及日常生活中有着广泛的应用。目前常用的镍镉(NiCd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____(填字母序号)。
2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____(填字母序号)。
①放电时Cd作正极 ②放电时Ni元素被还原
③充电时化学能转变为电能 ④放电时化学能转变为电能
Ⅲ.氢气和氧气可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式(当电解质溶液为NaOH(aq)或KOH(aq)时)两种。试回答下列问题:
(1)酸式电池的电极反应:正极_____;
(2)碱式电池的电极反应:负极_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com