
����Ŀ������ʥ·��˹��ѧ�������͵��Ҵ�ȼ�ϵ�أ������ӣ�H+���ܼ�����200�����ҹ��磮����ܷ�ӦΪ��C2H5OH+3O2��2CO2+3H2O����ͼ�Ǹõ�ص�ʾ��ͼ������˵����ȷ���ǣ� �� 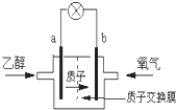
A.a��Ϊ��ص�����
B.��ع���ʱ������a���ص��߾������ٵ�b��
C.��������ĵ缫��ӦΪ��4H++O2+4e���T2H2O
D.��ع���ʱ��1mol�Ҵ�������ʱ����6mol����ת��
���𰸡�C
���������⣺A��ԭ��ع���ʱ���������������ƶ�����aΪ��������A����
B����ع���ʱ�����������������·�������ڸõ������b������a������B����
C�����������õ����ӱ���ԭ���缫��ӦʽΪ4H++O2+4e��=2H2O����C��ȷ��
D���Ҵ���CԪ�صĻ��ϼ�Ϊ��2�ۣ������������ߵ�+4�ۣ����ع���ʱ��1mol�Ҵ�������ʱ����12mol����ת�ƣ���D����
��ѡC��
�����ӵ��ƶ������֪aΪ������a�������Ҵ�ʧ���ӷ���������Ӧ���Ҵ�����������CO2��H+ �� �缫��ӦʽΪC2H5OH+3H2O��12e���T2CO2+12H+ �� bΪ������������ԭ��Ӧ���缫����ʽΪ4H++O2+4e���T2H2O���Դ˽����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ó�ȥ����CN����Cl�� ��ˮ�е�CN��ʱ��������ҺpHΪ9��10������������ClO����CN������Ϊ��������Ⱦ�����壬����˵������ȷ���ǣ� �� 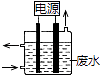
A.��ʯī����������������
B.�����ĵ缫��Ӧʽ��Cl��+2OH����2e���TClO��+H2O
C.�����ĵ缫��Ӧʽ��2H2O+2e���TH2��+2OH��
D.��ȥCN���ķ�Ӧ��2CN��+5ClO��+2H+�TN2��+2CO2��+5Cl��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ŷŵĵ������úȼ�ղ����Ķ��������ǵ������������ġ�������ס�������̿�ɴ���������Ⱦ��NO����5L�ܱ������м���NO�ͻ���̿�����������ʣ���һ����������������E��F�����¶ȷֱ���T1��T2ʱ����ø�����ƽ��ʱ���ʵ�����n/mol�������
���� | ����̿ | NO | E | F |
��ʼ | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
��1��д��NO�����̿��Ӧ�Ļ�ѧ����ʽ��
��2������������ӦT1��ʱ��ƽ�ⳣ��K1=��
��3��������ӦT1��ʱ�ﵽ��ѧƽ�����ͨ��0.1molNO���壬��ﵽ�»�ѧƽ��ʱNO��ת����Ϊ��
��4����ͼΪ��T1��ﵽƽ�����t2��t3��t4��t5ʱ�ı�ijһ����Ӧ������ƽ����ϵ�з�Ӧ������ʱ��仯������������ı����������ͬ����֪t3��t4��Ϊʹ�ô��������жϸ÷�Ӧ��H0��������������� 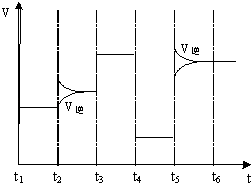
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶���2L�ܱ������У�3�����������ʼ״̬��ƽ��״̬ʱ�����ʵ�����n�����±���ʾ��
X | Y | W | |
��ʼ״̬��mol�� | 2 | 1 | 0 |
ƽ��״̬��mol�� | 1 | 0.5 | 1.5 |
�����й�˵����ȷ���ǣ� ��
A.���¶��£��÷�Ӧ��ƽ�ⳣ��K=9
B.�����¶ȣ���W�����������С���˷�Ӧ��H��0
C.���¶��£��÷�Ӧ�ķ���ʽΪ 2X��g��+Y��g��3W��g��
D.����ѹǿ�������淴Ӧ���ʶ�����ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������������е�һԪӲ�Ҳ���Ϊ��о�����������������յĵ��ԭ��������Ϊ��Ӳ������ʱ����оӦ���� ��
A.����
B.����
C.����
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.CH4��CH3CH2CH2CH3����������2����CH2������˶�����ͬϵ��
B.![]() �Ƿ�����
�Ƿ�����
C.����Ĺ������ǩ�CHO
D.���Ǻ���̼Ԫ�صĻ����ﶼ�����л���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
��1����ͼ��N2��g����H2��g����Ӧ����1mol NH3��g�������������仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ���� 
��2������֪�������ݣ�
��ѧ�� | H��H | N��N |
����/kJmol��1 | 435 | 943 |
�Ը��ݱ��м�ͼ�����ݼ���N��H�ļ���kJmol��1
��3���ϳɰ���Ӧͨ��������ý��������ʹ������ý��E1��E2�ı仯�ǣ�E1 �� E2�����������С���������䡱����
��4����NH3����ԭNOX���������������������Ⱦ������
4NH3��g��+3O2��g��=2N2��g��+6H2O��g������H1=akJ/mol
N2��g��+O2��g��=2NO��g������H2=bkJ/mol
��1mol NH3��ԭNO��N2 �� ��÷�Ӧ�����еķ�Ӧ�ȡ�H3=kJ/mol���ú�a��b��ʽ�ӱ�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijͬѧ��Ƶ�̽����Ӧ��ЧӦ�Ĺ۲�װ�á������˳���ǣ�����ͼ��ʾ��ʵ��װ�����Ӻá�����U�ι��ڼ���������īˮ��Һ(��Ʒ��)����T�ι������У�ʹU�ι������ߵ�Һ�洦��ͬһˮƽ�棬�ټн������С������м���Թ���ʢ��1 g �����ƣ�������2 mL���ҵ�����ˮ���ɹ۲졣
�Իش�
��1��ʵ���й۲쵽��������_________________________��
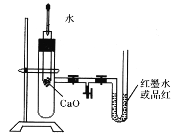
��2����ʵ���б�����е�һ��ʵ�������____________________��
��3����ʵ���ԭ����____________________________________��
��4��ʵ���н��еĻ�ѧ����ʽ��____________________��
��5����ʵ�����CaO��H2O��������Ca(OH)2������֮��Ĺ�ϵΪ_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���������õ������������з�����ȡ�ģ�
4HCl(Ũ)��MnO2![]() Cl2����MnCl2��2H2O
Cl2����MnCl2��2H2O
һ��ʵ���У��ù�����Ũ����(���ܶ�Ϊ1.19 g��mL��1��HCl����������Ϊ36.5%)��һ������MnO2��Ӧ��MnO2��ȫ�ܽ⣬������5.6 L(��״����)���������Լ��㣺
(1)Ũ��������ʵ���Ũ�ȡ�
(2)��������HCl�����ʵ�����
(3)MnO2��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com