
【题目】车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如表:
物质 | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(1)写出NO与活性炭反应的化学方程式;
(2)计算上述反应T1℃时的平衡常数K1=;
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为;
(4)如图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一个反应条件,平衡体系中反应速率随时间变化的情况,且所改变的条件均不同.已知t3﹣t4阶段为使用催化剂.请判断该反应△H0(填“>”或“<”). 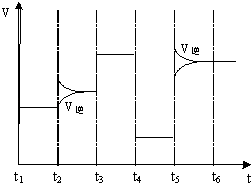
【答案】
(1)C+2NO?N2+CO2
(2)4
(3)80%
(4)<
【解析】解:(1)由表中数据可知,C、NO、E、F的化学计量数之比为(3.000﹣2.960):(0.10﹣0.020):0.040:0.040=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2 , 且该反应为可逆反应,反应方程式为C+2NON2+CO2 ,
故答案为:C+2NON2+CO2;(2)平衡时c(NO)= ![]() =0.010mol/L,c(N2)=c(CO2)=
=0.010mol/L,c(N2)=c(CO2)= ![]() =0.020mol/L,故T2℃时该反应的平衡常数为K2=
=0.020mol/L,故T2℃时该反应的平衡常数为K2= ![]() =4,
=4,
故答案为:4; (3)反应C+2NON2+CO2是一个气体体积不变的反应,而反应物只有一种,故加入NO气体,建立的平衡和原平衡为等效平衡,原平衡中NO转化率为 ![]() =80%,则达到新平衡时NO的转化率为80%,
=80%,则达到新平衡时NO的转化率为80%,
故答案为:80%; (4)改变的条件均不同,t5时刻,正逆反应速率均增大,且逆反应速率大于正反应速率,故t5时刻改变条件为升温,所以正反应为放热反应,升温平衡逆向移动,T1<T2 , 该反应△H<0,
故答案为:<.
(1)由表中数据可知,C、NO、E、F的化学计量数之比为(3.000﹣2.960):(0.10﹣0.020):0.040:0.040=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;(2)计算各气体的平衡浓度,代入平衡常数表达式计算;(3)反应C+2NON2+CO2是一个气体体积不变的反应,而反应物只有一种,故加入NO气体,建立的平衡和原平衡为等效平衡;(4)t2、t3、t4、t5时改变某一种反应条件,所改变的条件均不同,可以判断每一时刻改变的条件.


科目:高中化学 来源: 题型:
【题目】已知:Fe2O3(s)+3C(石墨)![]() 2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol1①
2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol1①
CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=283.0 kJ·mol1②
CO2(g) ΔH=283.0 kJ·mol1②
C(石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1③
CO2(g) ΔH=393.5 kJ·mol1③
则4Fe(s)+3O2(g)![]() 2Fe2O3(s)的ΔH为
2Fe2O3(s)的ΔH为
A.+1 164.1 kJ·mol1 B.1 641.0 kJ·mol1
C.259.7 kJ·mol1 D.519.4 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业的核心反应:N2(g)+3H2(g)![]() 2NH3(g)的反应过程中能量变化如图所示,回答下列问题:
2NH3(g)的反应过程中能量变化如图所示,回答下列问题:
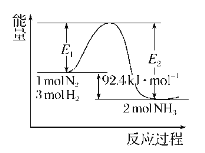
(1)ΔH=______;在反应体系中加入催化剂,反应速率增大,E2的变化是______(填“增大”“减小”或“不变”);△H (填“增大”“减小”或“不变”)。
(2)在500℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_______(填“<”“>”或“=”)46.2 kJ,理由__________________________________。
(3)已知在25℃、101 kPa时,14克CO气体完全燃烧放出热量为Q kJ。
请写出CO燃烧热的热化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s,白)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH1
②Sn(s,灰)+2HCl(aq)===SnCl2(aq)+H2(g) ΔH2
③Sn(s,灰) ![]() Sn(s,白) ΔH3=+2.1kJ·mol-1
Sn(s,白) ΔH3=+2.1kJ·mol-1
下列说法正确的是( )
A. ΔH1>ΔH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100g碳燃烧所得气体中,CO占![]() ,CO2占
,CO2占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g)===CO(g);ΔH(298K)=-110.35kJ·mol-1,CO(g)+
O2(g)===CO(g);ΔH(298K)=-110.35kJ·mol-1,CO(g)+![]() O2(g)===CO2(g);ΔH(298K)=-282.57kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
O2(g)===CO2(g);ΔH(298K)=-282.57kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
A.392.92kJ B.2489.44kJ
C.784.92kJ D.3274.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应CH4(g)+H2O(g)CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.下列判断正确的是( ) 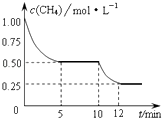
A.10min时,改变的外界条件可能是升高温度
B.0~5min内,v(H2)=0.1mol/(Lmin)
C.恒温下,缩小容器体积,平衡后c(H2)减小
D.12min时,反应达平衡的本质原因是气体总质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A.4g固体硫完全燃烧生成SO2,放出37 kJ热量:S(s)+O2(g)=SO2(g) ΔH= -296kJ/mol
B.1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:
N2(g)+3H2(g)![]() 2NH3(g) △H= -73kJ/mol
2NH3(g) △H= -73kJ/mol
C.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g) ==CO2(g)+ 2H2O(g) ΔH=-890.3kJ·mol-1
D.强酸强碱的中和热为- 57.3 kJ/mol:
Ba(OH) 2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l) ΔH=-114.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200℃左右供电.电池总反应为:C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( ) 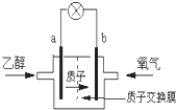
A.a极为电池的正极
B.电池工作时电流由a极沿导线经灯泡再到b极
C.电池正极的电极反应为:4H++O2+4e﹣═2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com