
����Ŀ���ϳɰ���ҵ�ĺ��ķ�Ӧ��N2(g)+3H2(g)![]() 2NH3(g)�ķ�Ӧ�����������仯��ͼ��ʾ���ش��������⣺
2NH3(g)�ķ�Ӧ�����������仯��ͼ��ʾ���ش��������⣺
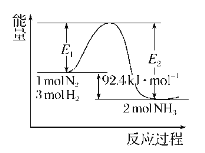
��1����H=______���ڷ�Ӧ��ϵ�м����������Ӧ��������E2�ı仯��______����������������С������������������H (�������С�����䡱)��
��2����500����2��107 Pa�ʹ�����������һ�ܱ������г���0.5 mol N2��1.5 mol H2����ַ�Ӧ�ų�������_______(�<����>������)46.2 kJ������__________________________________��
��3����֪��25����101 kPaʱ��14��CO������ȫȼ�շų�����ΪQ kJ��
��д��COȼ���ȵ��Ȼ�ѧ����ʽ��______________________________________��
���𰸡���1��92.4 kJ/mol ��С ����
��2��< �÷�ӦΪ���淴Ӧ����Ӧ���ת����С��100�����Էų�������С��46.2 kJ
��3��CO(g)+1/2O2(g)![]() 1/2CO2(g) ��H=2Q kJ/mol
1/2CO2(g) ��H=2Q kJ/mol
�����������⿼���˻�ѧ��Ӧ�������ı仯����1���������仯��ͼ��֪��N2(g)+3H2(g)![]() 2NH3(g) ��H= E1 E2=92.4 kJ/mol��ʹ�ô����ı䷴Ӧ;�������ͻ�ܣ���E2��С���Ӵ�����ͬ�ȳ̶ȵĸı����淴Ӧ���ʣ�ƽ�ⲻ�ƶ���������H���䡣
2NH3(g) ��H= E1 E2=92.4 kJ/mol��ʹ�ô����ı䷴Ӧ;�������ͻ�ܣ���E2��С���Ӵ�����ͬ�ȳ̶ȵĸı����淴Ӧ���ʣ�ƽ�ⲻ�ƶ���������H���䡣
��2�����ڸ÷�ӦΪ���淴Ӧ����Ӧ���ת����С��100�������Էų�������С��46.2 kJ��
��3��14��CO������ȫȼ�շų�����Q kJ����1 mol CO������ȫȼ�շų�����Ϊ![]() Q kJ=2Q kJ����COȼ���ȵ��Ȼ�ѧ����ʽΪ��CO(g)+1/2O2(g)
Q kJ=2Q kJ����COȼ���ȵ��Ȼ�ѧ����ʽΪ��CO(g)+1/2O2(g)![]() 1/2CO2(g) ��H=2Q kJ/mol��
1/2CO2(g) ��H=2Q kJ/mol��


 ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д� �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�Ʒ���һ�ּ�����ҩ��ṹ��ͼ��ʾ�������й���������ȷ���ǣ� �� 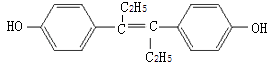
A.���л������ڷ�����
B.�����ʲ���ʹ���Ը��������Һ��ɫ
C.�÷��ӶԳ��Ժã�����û��˳���칹
D.���л�������У���������18��̼ԭ�ӹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ó�ȥ����CN����Cl�� ��ˮ�е�CN��ʱ��������ҺpHΪ9��10������������ClO����CN������Ϊ��������Ⱦ�����壬����˵������ȷ���ǣ� �� 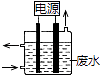
A.��ʯī����������������
B.�����ĵ缫��Ӧʽ��Cl��+2OH����2e���TClO��+H2O
C.�����ĵ缫��Ӧʽ��2H2O+2e���TH2��+2OH��
D.��ȥCN���ķ�Ӧ��2CN��+5ClO��+2H+�TN2��+2CO2��+5Cl��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ס��ҡ����������Ǻ�̼���ʡ����ж���һ���л���ס��ҡ������ܷ���ȼ�����ɱ���ͬʱ�ų��������ȣ��������Ӧʱ��Ҫ������������ס��ҡ��������ֱ��� ( )
A.CO��C��CO2��CH4B.C��CO2��CH4��CO
C.C��CO��CO2��CH4D.C��O2��CO2��CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͪ(C3H6O)ͨ������ɫҺ�壬������ˮ���ܶ�С��1 g��mL-1���е�ԼΪ55�档Ҫ��ˮ���ͪ�Ļ�����н���ͪ���������������Ϊ��������( )
A. ���� B. ��Һ C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ָ����Һ���ܴ���������ǣ� ��
A.ǿ����Һ�У�K+��Fe2+��MnO4����SO42��
B.![]() =0.1mol/L����Һ��Na+��K+��SiO32����NO3��
=0.1mol/L����Һ��Na+��K+��SiO32����NO3��
C.�����ܽ�Al��OH��3�����ܽ� H2SiO3����Һ�У�Na +��CO32����SO32����NO3��
D.�ں��д���HCO3������Һ�У�K+��Na+��AlO2����Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ŷŵĵ������úȼ�ղ����Ķ��������ǵ������������ġ�������ס�������̿�ɴ���������Ⱦ��NO����5L�ܱ������м���NO�ͻ���̿�����������ʣ���һ����������������E��F�����¶ȷֱ���T1��T2ʱ����ø�����ƽ��ʱ���ʵ�����n/mol�������
���� | ����̿ | NO | E | F |
��ʼ | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
��1��д��NO�����̿��Ӧ�Ļ�ѧ����ʽ��
��2������������ӦT1��ʱ��ƽ�ⳣ��K1=��
��3��������ӦT1��ʱ�ﵽ��ѧƽ�����ͨ��0.1molNO���壬��ﵽ�»�ѧƽ��ʱNO��ת����Ϊ��
��4����ͼΪ��T1��ﵽƽ�����t2��t3��t4��t5ʱ�ı�ijһ����Ӧ������ƽ����ϵ�з�Ӧ������ʱ��仯������������ı����������ͬ����֪t3��t4��Ϊʹ�ô��������жϸ÷�Ӧ��H0��������������� 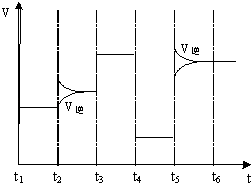
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
��1����ͼ��N2��g����H2��g����Ӧ����1mol NH3��g�������������仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ���� 
��2������֪�������ݣ�
��ѧ�� | H��H | N��N |
����/kJmol��1 | 435 | 943 |
�Ը��ݱ��м�ͼ�����ݼ���N��H�ļ���kJmol��1
��3���ϳɰ���Ӧͨ��������ý��������ʹ������ý��E1��E2�ı仯�ǣ�E1 �� E2�����������С���������䡱����
��4����NH3����ԭNOX���������������������Ⱦ������
4NH3��g��+3O2��g��=2N2��g��+6H2O��g������H1=akJ/mol
N2��g��+O2��g��=2NO��g������H2=bkJ/mol
��1mol NH3��ԭNO��N2 �� ��÷�Ӧ�����еķ�Ӧ�ȡ�H3=kJ/mol���ú�a��b��ʽ�ӱ�ʾ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com