
【题目】肼(N2H4)是火箭发动机的燃料,反应时N2O4为氧化剂,生成氮气和水蒸气.已知:N2(g)+2O2(g)=N2O4(g)△H=+8.7kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol.下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-542.7kJ/mol
B. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1059.3kJ/mol
C. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1076.7kJ/mol
D. N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g)△H=-1076.7kJ/mol
N2(g)+2H2O(g)△H=-1076.7kJ/mol
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景的本质原因是( )
A. 空气中的小水滴颗粒直径大小约为10-9m~10-7m
B. 光是一种胶体
C. 雾是一种胶体
D. 发生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( ) 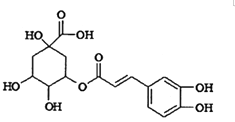
A.绿原酸分子中含有3种官能团
B.1 mol绿原酸最多能与7molNaOH发生反应
C.绿原酸能发生取代反应、加成反应和消去反应
D.绿原酸能使酸性高锰酸钾溶液、浓溴水褪色,但反应原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时还能制得氢气,具体流程如下: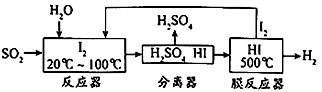
下列说法正确的是( )
A.分离器中的物质分离操作为过滤
B.膜反应器中,增大压强有利于提高HI的分解速率和平衡转化率
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+I2 = H2+2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物分子中的基团之间存在着相互影响.
(1)在甲烷、苯、甲苯这三种物质中,可以使酸性高锰酸钾溶液褪色的有(填名称),能用于制取炸药梯恩梯(TNT)的是(填分子式).
(2)某学习小组通过实验探究①苯酚、②醋酸、③碳酸这三种物质分子中的羟基在水中电离能力的强弱.主要实验步骤如下: a、取三支试管,分别加入三种物质的水溶液(适量),再分别滴加2~3滴紫色石蕊试液,发现仅②、③的溶液变红.
b、另取一支试管,加入少量滴加了酚酞的NaOH溶液,再滴加①的溶液,发现试管中溶液的红色明显变浅.
c、再取一支试管,加入少量碳酸钠溶液,向其中滴加②的溶液,发现有气体生成.
d、将CO2气体通入苯酚钠的水溶液中,发现溶液变浑浊.
请回答以下问题:
①步骤b的现象说明苯酚具有性.
②步骤d中,发生反应的化学方程式为 .
③三种物质分子中的羟基在水中的电离能力由强到弱的顺序是(填序号).
④在苯酚分子中,羟基对苯基的性质也有影响.写出苯酚与浓溴水反应生成的有机产物的结构简式: .
(3)同学甲设计了如右图所示的实验装置一次性地验证苯酚、醋酸、碳酸的酸性强弱.同学乙认为该实验装置设计的不严密,理由是 . 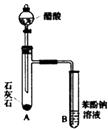
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。
①A元素最外层电子数是次外层电子数的2倍。
②B的阴离子和C的阳离子与氖原子的电子层结构相同。
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。
⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。
请写出:
(1)A元素的最高价氧化物的电子式 。
(2)B元素在周期表中的位置 。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有 。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为______________。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程的 。
(6)元素D与元素E相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填选项序号)。
a.常温下D的单质和E的单质状态不同
b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等。
(1)以丁烯和乙烯为原料制备丙烯的方法被称为“烯烃歧化法",主要反应为C4H8(g)+C2H4(g) ![]() 2C3H6(g)
2C3H6(g)
已知相关燃烧热数据:
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1411kJ·mol-1
C3H6(g)+ ![]() O2(g)=3CO2(g)+3H2O(l) △H2=-2049kJ·mol-1
O2(g)=3CO2(g)+3H2O(l) △H2=-2049kJ·mol-1
C4H8(g)+6O2(g)=4CO2(g)+4H2O(l) △H3=-2539kJ·mol-1
①乙烯的电子式为。
②相同质量的C2H4(g)、C3H6(g)和C4H8(g)充分燃烧,放出的热量由多到少的顺序依次为(填写化学式)。
③ 上述“烯烃歧化法”的反应的热化学方程式为。
(2)“丁烯裂解法”是另一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。
反应如下:主反应:3C4H8 ![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8 ![]() 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(p)变化的趋势分别如图1和图2所示: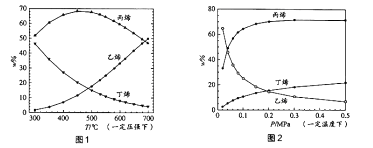
①平衡体系中的丙烯和乙烯的质量比[ ![]() ]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是(填字母序号)
]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是(填字母序号)
A. 300℃ 0.1MPa B. 700℃ 0.1MPa
C.300℃ 0.5MPa D.700℃ 0.5MPa
②有研究者结合图1数据并综合考虑各种因素,认为450℃的反应温度比300℃或700℃更合适,从反应原理角度分析其理由可能是。
③图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)═XY(g)△H>0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( ) 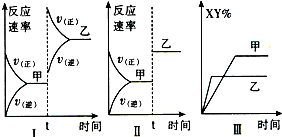
A.图I是升高温度的变化情况
B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况
D.图Ⅲ是升高温度的变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com