
【题目】下列物质属于电解质的是
A.NaClB.盐酸C.CuD.乙醇
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的燃料,反应时N2O4为氧化剂,生成氮气和水蒸气.已知:N2(g)+2O2(g)=N2O4(g)△H=+8.7kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol.下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-542.7kJ/mol
B. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1059.3kJ/mol
C. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1076.7kJ/mol
D. N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g)△H=-1076.7kJ/mol
N2(g)+2H2O(g)△H=-1076.7kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质分类全部正确的是
①纯碱 ②食盐水 ③石灰水 ④烧碱 ⑤液态氧 ⑥KClO3
A.碱——①④B.纯净物——③④⑤
C.盐——①⑥D.混合物——②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,反应装置略去).
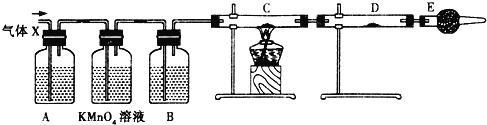
注:C中为氧化铜粉末,试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为:________________________________;
(2)乙同学认为还可能产生氢气的理由是:____________________________________;
(3)丙同学在安装好装置后,必不可少的一步操作是:__________________________;
(4)A中试剂是______,D中试剂是______;
(5)E装置的作用是_________________________;
(6)可以证明气体X中含有氢气的实验现象是:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴含的元素有80多种,它是一个巨大的宝藏。
(1)海水里钠的存在形式是_______。(填“游离态”或“化合态”)
(2)下列物质不经过化学变化就能从海水中获得的是_______。(填字母)
A.单质钠 B.单质钾 C.氯化钠
(3)写出钠的原子结构示意图_______。
(4)目前化学工业的主要支柱之一是氯碱工业,它是通过_____________ 来制取氯气等产品的工业,其原理用化学方程式表示为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在进行中和热的测定中,下列操作错误的是( )
A.测量溶液的温度计要一直插在溶液中
B.应该向酸(碱)中慢慢滴加碱(酸)
C.反应前需要用温度计测量酸(碱)温度
D.反应中酸或碱应适当过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象。请回答:
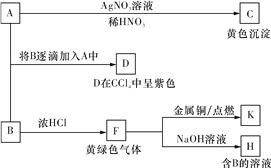
(1)写出C、D的化学式或分子式:__________、____________。
(2)指出D中所含元素在周期表中的位置________________,指出K的水溶液由稀到浓的颜色变化________________。
(3)将SO2气体通入D溶液,D溶液变为无色,生成两种强酸。写出该反应的化学方程式:________________________________________________________________________。
(4)F与粗硅加热生成__________(填分子式),该物质经蒸馏提纯后在1 100 ℃下与氢气反应生成高纯硅,写出后一步骤反应的化学方程式:_____________________________。
(5)0.25 mol F缓慢通入含有0.1 mol FeBr2、0.1 mol FeI2的混合溶液中,充分反应,试用一个离子方程式表示总反应:__________________________________________。
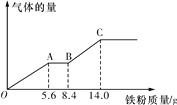
(6)某稀硫酸和稀硝酸的混合溶液100 mL,将其平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示(假设硝酸的还原产物为NO气体)。则原混合溶液中NO3-的物质的量为__________,硫酸的物质的量浓度为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com