
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 0.3 mol·L-1A1(NO3)3溶液中含A13+数小于0.3 NA
B. H2(g)+I2(g)![]() 2HI(g) △H= - akJ·mol-1,向密闭容器中加入NA个氢分子和NA个碘分子,充分反应后放出的热量为akJ
2HI(g) △H= - akJ·mol-1,向密闭容器中加入NA个氢分子和NA个碘分子,充分反应后放出的热量为akJ
C. 常温常压下,28 g C2H4、CO的混合气体中含有碳原子的数目为1.5NA
D. 标准状况下, Zn│H2SO4(1mol·L-1)│Cu原电池中,正极产生1.12 L H2时,转移的电子数为0.1NA
【答案】D
【解析】
A. 若为1L、0.3molL-1的AlCl3溶液中,由于Al3+水解,含Al3+的数目小于0.3NA,由于溶液体积未知,无法计算并判断所含Al3+的数目,故A错误;
B. 该反应为可逆反应,NA个氢分子和NA个碘分子,不可能完全反应生成2molHI(g),故放出的热量比akJ少,故B错误;
C. C2H4、CO的摩尔质量都是28g/mol,混合气体28g,物质的量为1mol,含有碳原子数目与二者的比例关系有关,当二者物质的量为1:1时,含有碳原子的数目为1.5NA,故C错误;
D. 用锌、铜作电极,铜为原电池的正极,电解质为硫酸,正极反应为2H++2e-=H2↑,
n(H2)=![]() =0.05mol,则H+得到0.05mol
=0.05mol,则H+得到0.05mol![]() 2=0.1mol电子,即转移的电子数为0.1NA,故D正确。
2=0.1mol电子,即转移的电子数为0.1NA,故D正确。
故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以NA 表示阿伏加德罗常数,下列说法正确的是
A. T℃时,1LpH=6纯水中,含10-8NA个OH-
B. 15.6gNa2O2 与过量CO2反应时,转移的电子数为0.4NA
C. pH=1的H3PO4溶液中含有0.1NA个H+
D. 1molCO和N2混合气体中含有的质子数是14NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马来酸氯苯那敏又名扑尔敏(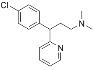 )是一种常见的抗过敏药物,其合成路线如下:
)是一种常见的抗过敏药物,其合成路线如下:
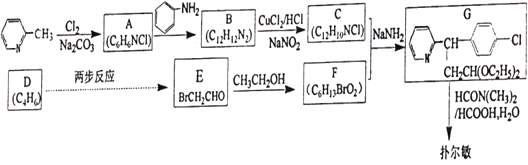
已知:碳碳双键可以被臭氧氧化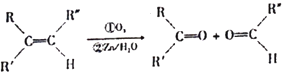
请回答下列问题:
(1)下列说法中不正确的是________。
A.扑尔敏的分子式为C16H18N2Cl
B.G分子中含有两个手性碳原子
C.化合物C中所有原子可能共平面
D.化合物E能发生取代、加成、氧化、还原反应
(2)化合物B的结构简式是________。
(3)E![]() F的化学方程式是________。
F的化学方程式是________。
(4)写出同时符合下列条件的化合物B(C12H12N2)两个同分异构体的结构简式________。
①分子中含有两个六元环;②1H-NMR谱显示有3个峰。
(5)设计由D经两步反应得到E的合成路线(用流程图表示,无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按化学反应中元素化合价是否发生变化,无机反应可以分为氧化还原反应和非氧化还原反应。这种分类方法与将无机反应按反应形式的不同分为四种基本反应类型是完全不同的分类方式,这二者的关系如图。

图中方框内区域表示所有的化学反应,大圆内区域表示氧化还原反应,大圆外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型。请分别填出:
(1)化学反应可以分为哪四种基本反应类型:___、___、___、___。
(2)若图中B圈表示化合反应,则:
B圈与氧化还原反应重叠的阴影部分表示哪一类反应?___________;
C圈与氧化还原反应重叠的阴影部分表示哪一类反应?______________;
请分别举出符合以上两种情况的一个例子:________; ___________。
(3)下列说法正确的是___。
A.置换反应一定属于氧化还原反应
B.有单质参加和有单质生成的化学反应一定是氧化还原反应
C.化学反应中有一种物质被氧化,必定有另外一种物质被还原
D.氧化还原反应发生的本质是化合价发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当今环境污染已成为人类面临的重大威胁,下列对应关系不完全正确的是
A.酸雨——SO2、NO2、CO2等B.光化学烟雾——NO2、CxHy、CO等
C.温室效应——CO2、CH4等D.白色污染——各种颜色的难降解的塑料膜、袋等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们应该从化学的角度认识生活中的问题,下列说法正确的是( )
A.生活污水不是化工废水,可向江河湖泊里任意排放
B.铵态氮肥与草木灰混合使用可以明显提高肥效
C.可以用灼烧闻气味的方法区分涤纶和羊绒
D.通过观察颜色和闻气味可以辨别保鲜膜成分是聚乙烯塑料还是聚氯乙烯塑料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将![]() 还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
Ⅰ.将软锰矿(主要成分MnO2)粉碎后,与KOH固体混合,通入空气充分焙烧,生成暗绿色熔融态物质。
Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
Ⅲ.向暗绿色溶液中通入CO2,溶液变为紫红色,同时生成黑色固体。
Ⅳ.过滤,将紫红色溶液蒸发浓缩,冷却结晶,过滤,洗涤,干燥,得KMnO4固体。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
(1)Ⅰ中,粉碎软锰矿的目的是_____。
(2)Ⅰ中,生成K2MnO4的化学方程式是_____。
(3)Ⅱ中,浸取时用稀KOH溶液的原因是_____。
(4)Ⅲ中,CO2和K2MnO4在溶液中反应的化学方程式是_____。
(5)将K2MnO4溶液采用惰性电极隔膜法电解,也可制得KMnO4.装置如图:
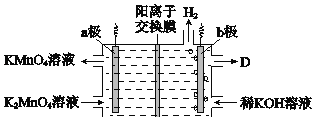
①b极是_____极(填“阳”或“阴”),D是____________。
②结合电极反应式简述生成KMnO4的原理:___________。
③传统无膜法电解时,锰元素利用率偏低,与之相比,用阳离子交换膜可以提高锰元素的利用率,其原因是__________。
(6)用滴定法测定某高锰酸钾产品的纯度,步骤如下:
已知:Na2C2O4 +H2SO4 ═H2C2O4 +Na2SO4
5H2C2O4 +2MnO4﹣+6H+═2Mn2++10CO2↑+8H2O
摩尔质量:Na2C2O4 134g/mol KMnO4 158g/mol
ⅰ.称取ag产品,配成50mL溶液。
ⅱ.称取bgNa2C2O4,置于锥形瓶中,加蒸馏水使其溶解,再加入过量的硫酸。
ⅲ.将锥形瓶中溶液加热到75℃~80℃,恒温,用ⅰ中所配溶液滴定至终点,消耗溶液V mL(杂质不参与反应)。
产品中KMnO4的质量分数的表达式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com