
| A. | Al、Fe | B. | Mg、Al | C. | Zn、Fe | D. | Zn、Cu |
分析 计算氯气的物质的量,根据电子转移守恒,计算提供1mol电子需要金属的平均质量,据此解答.
解答 解:71g氯气的物质的量=$\frac{71g}{71g/mol}$=1mol,转移电子物质的量=1mol×2=2mol,故提供1mol电子需要金属的质量为:50g×$\frac{1mol}{2mol}$=25g,
A、Al的电子摩尔质量为9g、Fe的电子摩尔质量为18.7g,提供1mol电子平均质量为9g~18.67g之间,不符合题意,故A错误;
B、Mg的电子摩尔质量为12g、Al的电子摩尔质量为9g,提供1mol电子平均质量为9g~12g之间,不符合题意,故B错误;
C、Zn的电子摩尔质量为32.5g、Fe的电子摩尔质量为18.7g,提供1mol电子平均质量为18.7g~32.5g之间,符合题意,故C正确;
D、Zn的电子摩尔质量为32.5g、Cu的电子摩尔质量为32g,提供1mol电子平均质量为32g~32.5g之间,不符合题意,故D错误;
故选C.
点评 本题考查混合物的计算,难度中等,侧重考查学生分析思维能力,注意平均值的应用.


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | B. | 乙醇的分子式:C2H4O | ||
| C. | 四氯化碳的电子式: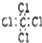 | D. | 异丁烷的结构简式:CH(CH3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子.回答下列问题:
原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性强弱:R>W>X | |
| C. | Y的氢化物比R的氢化物稳定,熔沸点高 | |
| D. | Y与Z形成的两种化合物中阴、阳离子的个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
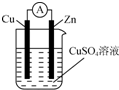 将锌棒和铜棒按图示方式插入CuSO4溶液中,电流计指针发生偏转,下列针对该装置的说法正确的是( )
将锌棒和铜棒按图示方式插入CuSO4溶液中,电流计指针发生偏转,下列针对该装置的说法正确的是( )| A. | 该装置是将电能转化为化学能 | |
| B. | 锌棒为正极 | |
| C. | 电子由铜棒流出 | |
| D. | 该电池总反应为Zn+CuSO4═ZnSO4+Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀并迅速变成灰绿色,最终变为红褐色 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,有红色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某种食品的配料标签如图所示.
某种食品的配料标签如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com