
溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。

实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL 溴乙烷,将试管如图固定后,加热。
(1)请写出该反应的化学方程式 。
(2)观察到 现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)欲将生成的乙醇从反应混合物中进行分离出来,最简单的操作是 。
(4)请简述如何检验溴乙烷中含有溴元素 。
实验操作II:在试管中加入5 mL NaOH乙醇溶液和5 mL 溴乙烷,将试管如图固定后,加热。
(5)请写出该反应的化学方程式 。
(6)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是 ,检验的方法是 (需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
(1)CH3CH2Br + NaOH CH3CH2OH + NaBr (2分)
CH3CH2OH + NaBr (2分)
(2)混合物不分层 (1分)
(3)蒸馏 (1分)
(4)加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液有浅黄色沉淀生成(2分)
(5)CH3CH2Br + NaOH CH2=CH2 ↑+ NaBr + H2O (2分)
CH2=CH2 ↑+ NaBr + H2O (2分)
(6) CH2=CH2 ; (1分) 将生成的气体通入稀溴水,溴水褪色。(其他合理答案也可)(2分)
【解析】
试题分析:(1)溴乙烷在氢氧化钠的水溶液中发生取代反应生成乙醇和溴化钠,化学方程式为
CH3CH2Br + NaOH CH3CH2OH + NaBr ;
CH3CH2OH + NaBr ;
(2)生成的产物乙醇与水互溶,所以混合物不分层现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)乙醇的沸点低,所以将乙醇从溶液中分离出来只能采用蒸馏的方法;
(4)检验溴乙烷中含有溴元素,需要硝酸银溶液,再加入硝酸银溶液前先加酸使溶液呈酸性,在加入硝酸银溶液,具体操作是加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液有浅黄色沉淀生成;
(5)溴乙烷在氢氧化钠的醇溶液中发生消去反应生成乙烯和溴化钠、水,化学方程式为
CH3CH2Br + NaOH CH2=CH2 ↑+ NaBr + H2O;
CH2=CH2 ↑+ NaBr + H2O;
(6)无论溴乙烷发生取代还是消去反应共同产物是溴化钠,所以证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,只能检验产物乙烯;检验的方法是将生成的气体通入稀溴水,溴水褪色;或通入酸性高锰酸钾溶液,紫色褪去。
考点:考查不同条件的卤代烃的反应不同,化学方程式的书写,产物的检验


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届湖北省新高三起点调研测试化学试卷(解析版) 题型:填空题
(8分)U、W、X、Y、Z都是短周期元素,且原子序数依次增大。其中U与W可形成三角锥形分子甲,U与X可形成常温下呈液态的分子乙,甲、乙均为10 电子分子;Y 元素原子的 K 层电子数与M层电子数相同;Z元素的单质、氧化物均为原子晶体。请回答下列问题:
(1) Z元素在周期表中的位置 。
(2)X、Y、Z三种元素的原子半径由小到大的顺序是 (用元素符号表示)。
(3)U与X形成的18电子化合物的电子式是 。
(4) ZX2与NaOH溶液反应的化学方程式是 。
(5)已知:① N2(g) + 3H2 (g)= 2NH3 (g) △H=-92.4kJ/mol
②2H2(g) + O2(g) = 2H2O(g) △H=-483.6kJ/mol
试写出氨气完全燃烧生成气态水的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省孝感市七校联考高二下学期期中考试化学试卷(解析版) 题型:选择题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
C.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
D.氨气分子是极性分子而甲烷是非极性分子。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省协作体高考摸底测试理科综合化学试卷(解析版) 题型:填空题
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。
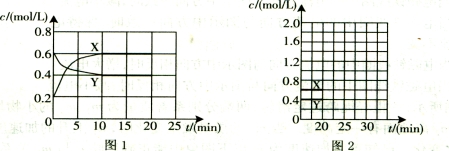
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为
;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此
时测得c(NO2)=0.9 mol/L。
第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和
“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学
电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:

该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
查看答案和解析>>
科目:高中化学 来源:2015届浙江省协作体高考摸底测试理科综合化学试卷(解析版) 题型:选择题
在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
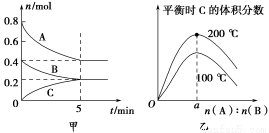
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高二下学期期中联考化学试卷(解析版) 题型:选择题
下列有关除杂质(括号中为杂质)的操作中,错误的是
A、福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B、溴乙烷(乙醇):多次加水振荡,分液,弃水层
C、乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
D、苯(苯酚):加溴水,振荡,过滤除去沉淀
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高二下学期期中联考化学试卷(解析版) 题型:选择题
下列有关同分异构体数目的叙述不正确的是 ( )
A.若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种
B.与 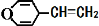 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
C.含有5个碳原子的饱和链烃,其一氯取代物共有8种
D.菲的结构简式为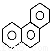 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期初联考化学试卷(解析版) 题型:选择题
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )
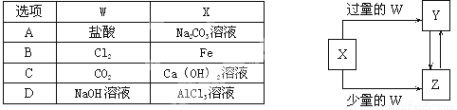
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州地区六校高二下学期期中联考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数。下列叙述正确的是
A.常温常压下,22 g CO2中含有NA个C=O键
B.标准状况下,将22.4L氯化氢气体溶于足量水中,溶液中含有的氯化氢分子数为NA
C.常温常压下,22.4 L N2和O2的混合气体中含有的分子数目为NA
D.9 g重水含有的电子数为5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com