
【题目】用NH3催化还原氮的氧化物,可以消除氮的氧化物的污染。已知:
反应①:4NH3(g)+ 6NO(g)![]() 5N2(g) + 6H2O(l) △H1
5N2(g) + 6H2O(l) △H1
反应②:2NO(g) + O2(g)![]() 2NO2(g) △H2(△H2<0且
2NO2(g) △H2(△H2<0且![]() )
)
反应③:4NH3(g) + 6NO2(g)![]() 5N2(g)+ 3O2 + 6H2O(l) △H3
5N2(g)+ 3O2 + 6H2O(l) △H3
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:
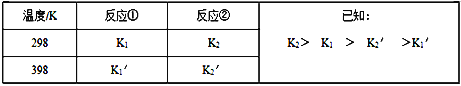
(1)试推测反应③是______ 反应(填“吸热”或“放热”)
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如图所示。

则:
①计算0~4min时在A催化剂作用下,反应速率v(NO)=__________。
②下列说法正确的是:__________________。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?_______(填“是”或“不是”。已知该温度下该反应的K约为147.3)。达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和0.9mol的O2,则还要加入NO______mol、O2_____mol,达平衡时各物质的浓度才能跟前平衡的相等。
【答案】 吸热 v(NO)=0.375mol/L CD 不是 0.8mol 0.5mol
【解析】(1)根据表中数据可知升高温度反应①、②的平衡常数均减小,这说明二者均是放热反应。根据盖斯定律可知①-②×3即得到反应③的△H3=△H1-3△H2,由于△H2<0且![]() ),所以△H3=△H1-3△H2>0,因此反应③是吸热反应;(2)①0~4min时在A催化剂作用下此时生成氮气是2.5mol,所以消耗NO是2.5mol×6/5=3.0mol,浓度是1.5mol/L,反应速率v(NO)=1.5mol/L÷4min=0.375mol/L。②A.曲线斜率越大,反应速率越大,活化能越小,则该反应的活化能大小顺序是:Ea(A)<Ea(B) <Ea(C),A错误;B.增大压强能使反应速率加快的原因,是因为增加了单位体积内活化分子的百分数,活化分子的百分数不变,B错误;C.根据方程式可知单位时间内H-O键与N-H断裂的数目相等时,说明正逆反应速率相等,反应已达平衡状态,C正确;D.若在恒容绝热的密闭容器中进行,当温度不变时,说明正逆反应速率相等,反应已达平衡状态,D正确,答案选CD;(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO和2 molO2,反应一段时间后,测的生成NO21.6mol,则根据方程式可知消耗NO和氧气分别是1.6mol、0.8mol,剩余NO和氧气分别是0.4mol、1.2mol,此时NO、氧气、二氧化氮的浓度分别是(mol/L)0.2、0.6、0.8,浓度熵为
),所以△H3=△H1-3△H2>0,因此反应③是吸热反应;(2)①0~4min时在A催化剂作用下此时生成氮气是2.5mol,所以消耗NO是2.5mol×6/5=3.0mol,浓度是1.5mol/L,反应速率v(NO)=1.5mol/L÷4min=0.375mol/L。②A.曲线斜率越大,反应速率越大,活化能越小,则该反应的活化能大小顺序是:Ea(A)<Ea(B) <Ea(C),A错误;B.增大压强能使反应速率加快的原因,是因为增加了单位体积内活化分子的百分数,活化分子的百分数不变,B错误;C.根据方程式可知单位时间内H-O键与N-H断裂的数目相等时,说明正逆反应速率相等,反应已达平衡状态,C正确;D.若在恒容绝热的密闭容器中进行,当温度不变时,说明正逆反应速率相等,反应已达平衡状态,D正确,答案选CD;(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO和2 molO2,反应一段时间后,测的生成NO21.6mol,则根据方程式可知消耗NO和氧气分别是1.6mol、0.8mol,剩余NO和氧气分别是0.4mol、1.2mol,此时NO、氧气、二氧化氮的浓度分别是(mol/L)0.2、0.6、0.8,浓度熵为![]() ,所以该反应没有达到平衡状态。达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和0.9mol的O2,则相当于是1.2molNO和1.5mol氧气,所以根据等效平衡可知还要加入NO为2mol-1.2mol=0.8mol、O2为2mol-1.5mol=0.5mol,达平衡时各物质的浓度才能跟前平衡的相等。
,所以该反应没有达到平衡状态。达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和0.9mol的O2,则相当于是1.2molNO和1.5mol氧气,所以根据等效平衡可知还要加入NO为2mol-1.2mol=0.8mol、O2为2mol-1.5mol=0.5mol,达平衡时各物质的浓度才能跟前平衡的相等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】柔性电子产品因具有独特的柔性、延展性等优点在信息、医疗、能源等领域具有广泛应用前景。下图为中科院张新波课题组受中国传统书法艺术启发,直接将用毛笔书写后的纸张和锂箔作为电极材料组装成的锂空气电池。下列说法不正确的是( )

A. 纸张电极是该电池的正极
B. 锂箔电极发生的电极反应:Li﹣e-=Li+
C. 电池工作时,电子从锂箔电极经导线流向纸张电极,再从纸张电极经电解质溶液流向锂箔电极
D. 该电池具有轻型、柔性且可折叠的特点,有望应用于柔性电子器件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于水解反应的是( )
A. CO32-+H2O![]() HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
C. A1O2-+HCO3-+H2O=Al(OH)3↓+CO32- D. Al3++3A1O2-+6H2O=4Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH + H2![]() LiNH2+LiH。下列有关说法正确的是( )
LiNH2+LiH。下列有关说法正确的是( )
A. Li2NH中N的化合价是-1 B. 该反应中H2既是氧化剂又是还原剂
C. Li+和H-的离子半径相等 D. 此法储氢和钢瓶储氢的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+,而可能含有Fe2+,合理的操作顺序是( )
①加入足量的氯水 ② 取少量试液 ③加入少量KSCN溶液
A. ①③② B. ③②① C. ②③① D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。

(1)聚合物F的结构简式_________________。A→B的反应条件为____________。
(2)D的结构简式_________________。B转化为C的化学反应方程式是___________。
(3)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是______________________________。
(4)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol H2,则该种同分异构体的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()

A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 摩尔是6.02×1023个结构微粒的集体
B. 0.012kg12C所含的原子数精确值是6.02×1023
C. 1mol H就是1mol氢
D. 1molH2SO4的质量是98g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有NaBr溶液的试管中加入少量氯水,振荡,再加入适量CCl4,振荡,静置。下列判断正确的是
选项 | A | B | C | D |
上层 | 红棕色 | 黄绿色 | 无色 | 无色 |
下层 | 无色 | 无色 | 红棕色 | 黄绿色 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com