
【题目】下列反应不属于水解反应的是( )
A. CO32-+H2O![]() HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
C. A1O2-+HCO3-+H2O=Al(OH)3↓+CO32- D. Al3++3A1O2-+6H2O=4Al(OH)3↓
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】(9分)某化学兴趣小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是 ,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)

乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①) ,(接②) ,说明反应放热。
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是 ,说明反应放热,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 配制FeCl2溶液时,加入铁粉的原因:Fe+Fe3+=2Fe2+
B. 二氧化锰和浓盐酸反应:MnO2+4HCl(浓)![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
C. “水玻璃”长期暴露在空气中会变质:SiO32-+CO2+H2O=H2SiO3↓+CO32-
D. 向硫酸氢钠溶液中滴加氢氧化钡溶液至中性:H++SO42++Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组采用活性炭回收海带化工提碘废水中残留的低浓度碘(主要以I-形式存在,杂质不参与反应),实验过程如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O;
I2+2S2O32-=2I-+S4O62-。
请回答:
(1)结合图1可知,NaNO2最适宜的添加量为_____mgL-1。
(2)操作X的目的是_____。
(3)系列操作中涉及抽滤操作,下列有关抽滤的说法中不正确的是_____。
A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.当溶液具有强酸性、强氧化性时,可用玻璃砂漏斗代替布氏漏斗
C.抽滤不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D.洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物
(4)进行操作Y时所用装置如图2所示(省去了夹持装置),则操作Y的名称为_____;该装置中有两处不合理,请指出其中的一处_____。
(5)称取0.5080g粗碘试样于250mL碘量瓶中,加入足量的KI溶液,加盖摇匀至碘完全溶解.迅速用0.1200molL-1Na2S2O3标准溶液滴定至浅黄色,再加入淀粉指示剂,继续滴定至蓝色褪去即为终点,共消耗Na2S2O3标准溶液24.00mL。则粗碘试样中碘单质的纯度为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年10月11日,神舟十一号飞船搭乘CZ﹣2F火箭成功发射。在重达495 吨的起飞重量中,95%的都是化学推进剂。
(1)降冰片烯![]() (C7H10)是一种重要的高密度液体燃料化学推进剂。已知:
(C7H10)是一种重要的高密度液体燃料化学推进剂。已知:
燃料 | 密度(gcm-3) | 体积热值(JL-1) |
降冰片烯 | 1.0 | 4.2×107 |
写出表示降冰片烯标准燃烧热的热化学方程式:_____。
(2)CH3OH和液氧是常用的液体火箭推进剂。
①已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)△H1
CH3OH(g)+H2O(l)△H1
2H2(g)+O2(l)=2H2O(l)△H2
CH3OH(g)=CH3OH(l)△H3
2CH3OH(l)+3O2(l)=2CO2(g)+4H2O(l)△H4
则△H4=_____(用△H1、△H2、△H3来表示)。
②某温度下,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。在体积为2L的密闭容器中加入1mol CH3OH和1mol H2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数_____。保持其它条件不变,在第5min时向体系中再充入0.2mol CO2和0.4mol H2,第8min重新达到平衡,此时c(H2)=c(CH3OH)。请在图中画出5到9min的c(CO2)变化曲线示意图。
CH3OH(g)+H2O(g)。在体积为2L的密闭容器中加入1mol CH3OH和1mol H2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数_____。保持其它条件不变,在第5min时向体系中再充入0.2mol CO2和0.4mol H2,第8min重新达到平衡,此时c(H2)=c(CH3OH)。请在图中画出5到9min的c(CO2)变化曲线示意图。
(3)NH4NO3也是一种重要的固体推进剂,可通过电解NO制备NH4NO3,其工作原理如图2所示,A电极的名称为_____极,请写出在B电极上发生的电极反应式:_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,请回答有关问题:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是 . (用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是 (用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程 .
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的 . (填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NH3催化还原氮的氧化物,可以消除氮的氧化物的污染。已知:
反应①:4NH3(g)+ 6NO(g)![]() 5N2(g) + 6H2O(l) △H1
5N2(g) + 6H2O(l) △H1
反应②:2NO(g) + O2(g)![]() 2NO2(g) △H2(△H2<0且
2NO2(g) △H2(△H2<0且![]() )
)
反应③:4NH3(g) + 6NO2(g)![]() 5N2(g)+ 3O2 + 6H2O(l) △H3
5N2(g)+ 3O2 + 6H2O(l) △H3
反应①和反应②在不同温度时的平衡常数及其大小关心如下表:
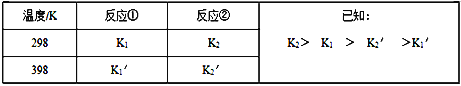
(1)试推测反应③是______ 反应(填“吸热”或“放热”)
(2)相同条件下反应①在2L的密闭容器中选用不同的催化剂,反应产生N2的物质的量随时间的变化如图所示。

则:
①计算0~4min时在A催化剂作用下,反应速率v(NO)=__________。
②下列说法正确的是:__________________。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B) >Ea(C)
B.增大压强能使反应速率加快的原因,是因为增加活化分子的百分数
C.单位时间内H-O键与N-H断裂的数目相等时,说明反应已达平衡状态
D.若在恒容绝热的密闭容器中进行,当温度不变时,说明反应已达平衡状态
(3)对于反应②,若在某温度下,在容积为2L的刚性密闭容器中起始加入2 molNO和2 molO2,反应一段时间后,测的生成NO21.6mol,则该反应是否达到平衡状态?_______(填“是”或“不是”。已知该温度下该反应的K约为147.3)。达平衡后,在同一温度下向大小相同的另一刚性容器中加入1.2mol的NO2和0.9mol的O2,则还要加入NO______mol、O2_____mol,达平衡时各物质的浓度才能跟前平衡的相等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com