
【题目】2016年10月11日,神舟十一号飞船搭乘CZ﹣2F火箭成功发射。在重达495 吨的起飞重量中,95%的都是化学推进剂。
(1)降冰片烯![]() (C7H10)是一种重要的高密度液体燃料化学推进剂。已知:
(C7H10)是一种重要的高密度液体燃料化学推进剂。已知:
燃料 | 密度(gcm-3) | 体积热值(JL-1) |
降冰片烯 | 1.0 | 4.2×107 |
写出表示降冰片烯标准燃烧热的热化学方程式:_____。
(2)CH3OH和液氧是常用的液体火箭推进剂。
①已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)△H1
CH3OH(g)+H2O(l)△H1
2H2(g)+O2(l)=2H2O(l)△H2
CH3OH(g)=CH3OH(l)△H3
2CH3OH(l)+3O2(l)=2CO2(g)+4H2O(l)△H4
则△H4=_____(用△H1、△H2、△H3来表示)。
②某温度下,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。在体积为2L的密闭容器中加入1mol CH3OH和1mol H2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数_____。保持其它条件不变,在第5min时向体系中再充入0.2mol CO2和0.4mol H2,第8min重新达到平衡,此时c(H2)=c(CH3OH)。请在图中画出5到9min的c(CO2)变化曲线示意图。
CH3OH(g)+H2O(g)。在体积为2L的密闭容器中加入1mol CH3OH和1mol H2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数_____。保持其它条件不变,在第5min时向体系中再充入0.2mol CO2和0.4mol H2,第8min重新达到平衡,此时c(H2)=c(CH3OH)。请在图中画出5到9min的c(CO2)变化曲线示意图。
(3)NH4NO3也是一种重要的固体推进剂,可通过电解NO制备NH4NO3,其工作原理如图2所示,A电极的名称为_____极,请写出在B电极上发生的电极反应式:_____。

【答案】 C7H10(l)+9.5O2(g)=7CO2(g)+5H2O(l)△H=-3948kJ/mol 3△H2-2△H1-2△H3 59.26 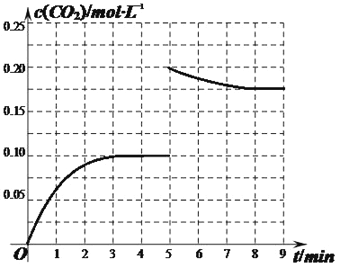 NO-3e-+2H2O=NO3-+4H+
NO-3e-+2H2O=NO3-+4H+
【解析】(1)C7H10的摩尔质量为94g/mol,故燃烧1mol降冰片烯标准燃烧热为△H=-(4.2×107J/L×94g/mol÷1000g/L)=-3948kJ/mol,故热化学方程式为C7H10(l)+9.5O2(g)=7CO2(g)+5H2O(l)①△H=-3948kJ/mol;(2)已知:
ⅰ、CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)△H1
CH3OH(g)+H2O(l)△H1
ⅱ、2H2(g)+O2(l)═2H2O(l)△H2
ⅲ、CH3OH(g)═CH3OH(l)△H3
根据盖斯定律可知3×ⅱ﹣2×ⅰ﹣2×ⅲ即得到2CH3OH(l)+3O2(l)═2CO2(g)+4H2O(l)的△H4=3△H2﹣2△H1﹣2△H3;
② CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度(mol/L)0 0 0.5 0.5
变化浓度(mol/L)0.1 0.3 0.1 0.1
平衡浓度(mol/L)0.1 0.3 0.4 0.4
所以k=0.4×0.4/0.2×0.33=59.26;反应物浓度增大,使平衡不断向正反应方向进行,因此图像为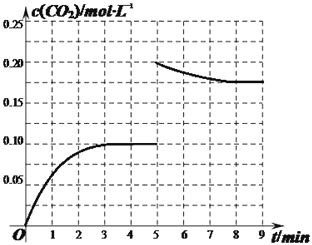 ;(3)由图可知,A极上NO生成NH4+,发生还原反应,为电解池阴极;B极上NO生成NO3﹣,发生氧化反应,故电极反应方程式为NO-3e-+2H2O=NO3-+4H+。
;(3)由图可知,A极上NO生成NH4+,发生还原反应,为电解池阴极;B极上NO生成NO3﹣,发生氧化反应,故电极反应方程式为NO-3e-+2H2O=NO3-+4H+。


科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液

(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体___g。
(2)从表中选择称量NaOH固体所需要的仪器是(填字母):___。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):___。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表:
①请填写下表中的空白:
| 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.3 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)___。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某矿物固体X(仅含4种短周期元素)的组成和性质,其中固体乙可制光导纤维。现设计并完成如下实验:

请回答:
(1)X除了含有H、O元素以外还含有____________。
(2)固体丙的用途____________。
(3)X的化学式是____________。
(4)固体乙与NaOH溶液反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠-过氧化氢-氯化钠加合物( 4Na2SO4·2H2O2·NaCl)又称固体双氧水,具有漂白、杀菌、消毒等作用,其性质较稳定,因此具有广泛的应用前景。化学实验室中制备硫酸钠—过氧化氢—氯化钠加合物的流程如下:

已知:过氧化氢在碱性条件下不稳定。
4Na2SO4·2H2O2·NaCl的相对分子质量为694.5。
回答下列问题:
(1)控温反应中,反应的温度控制在10℃左右,不能太高的原因是____________。
(2)可用减压过滤得到产品。减压过滤装置中的陶瓷材料仪器名称是____________。
(3)上述工艺流程中,步骤B的操作是________。
(4)硫酸钠一过氧化氢一氯化钠加合物(4Na2SO4·2H2O2·NaCl)固体比过碳酸钠(2Na2CO3·3H2O2)固体更稳定的原因是___________。
(5)准确称取8.000 g固体双氧水样品,配制成250.00mL溶液,量取25.00mL溶液于锥形瓶中,加适量稀硫酸酸化后,用0.04000mol/L KMnO4标准溶液滴定至终点,消耗KMnO4溶液20.00mL。判断滴定终点时的现象________________;产品的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于水解反应的是( )
A. CO32-+H2O![]() HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
C. A1O2-+HCO3-+H2O=Al(OH)3↓+CO32- D. Al3++3A1O2-+6H2O=4Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸、乙醇、浓H2SO4制取乙酸乙酯,加热蒸馏后,在饱和Na2CO3溶液的液面上得到无色油状液体,当振荡混合物时,有气泡产生,主要原因可能是( )
A.有部分H2SO4,被蒸馏出来了
B.有部分未反应的乙醇被蒸馏出来了
C.有部分未反应的乙酸被蒸馏出来了
D.有部分乙酸乙酯与碳酸钠反应了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+,而可能含有Fe2+,合理的操作顺序是( )
①加入足量的氯水 ② 取少量试液 ③加入少量KSCN溶液
A. ①③② B. ③②① C. ②③① D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质所含分子数最多的是( )
A. 0.5 mol Cl2 B. 标准状况下3.36 L CO
C. 5.6g N2 (N2的摩尔质量为28 g·mol-1) D. 含NA个分子的O2(NA为阿伏加德罗常数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com