
| A. | 在体积可变的密闭容器中发生可逆反应 A(g)+B(g)?C(g)+D(g),当混合气体的密度不再改变时,说明反应已达到化学平衡状态 | |
| B. | 对于反应 C(s)+CO2(g)?2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率可能减小 | |
| C. | 向 0.1 mol•L-1的氨水中加入氯化铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}0)}$增大 | |
| D. | 常温下,向 Mg(OH)2悬浊液中加入 MgCl2浓溶液后,溶液中$\frac{c(M{g}^{2+})•c(O{H}^{-})}{c({H}^{+})}$不变(一定温度下,Mg(OH)2悬浊液中 c(Mg2+)﹒c2(OH-)为定值) |
分析 A、混合气体的密度等于混合气体的质量和体积的比值,据此回答判断;
B、吸热反应,升高温度,化学平衡常数增大,升高温度,化学反应速率增加;
C、NH3•H2O电离常数只受温度影响,温度不变Kb不变,加入氯化铵固体,溶液中c(NH4+)增大.
D、溶液中存在氢氧化镁的溶解平衡,水的电离平衡,氢氧化镁Ksp=c(Mg2+)•c2(OH-),在一定温度下为常数,水的离子积Kw=c(H+)•c(OH-),一定稳定性Kw为常数,溶液中溶液中$\frac{c(M{g}^{2+})c(O{H}^{-})}{c({H}^{+})}$=$\frac{Ksp}{Kw}$,据此回答.
解答 解:A、体积可变的密闭容器中,气体质量始终不变,所以混合气体的密度变化,密度不再改变时,说明已达到化学平衡状态,故A正确;
B、影响化学平衡的因素是温度,该反应正反应是吸热反应,平衡常数增大说明温度升高,升高温度反应速率增大,故B错误;
C、NH3•H2O电离常数只受温度影响,温度不变Kb不变,加入氯化铵固体,溶液中c(NH4+)增大,则溶液Kb和铵根离子浓度比值减小,氢氧根离子和氨水浓度之比等于Kb和铵根离子浓度比值,故C错误;
D、溶液中存在氢氧化镁的溶解平衡,水的电离平衡,氢氧化镁Ksp=c(Mg2+)•c2(OH-),在一定温度下为常数,水的离子积Kw=c(H+)•c(OH-),一定温度下Kw为常数,溶液中溶液中$\frac{c(M{g}^{2+})c(O{H}^{-})}{c({H}^{+})}$=$\frac{Ksp}{Kw}$,不发生变化,故D正确.
故选:AD.
点评 本题考查平衡状态判断、平衡常数的运用、平衡常数的影响因素等,难度中等,注意平衡常数的书写与影响因素.


科目:高中化学 来源: 题型:选择题
| A. | 绿色更浅 | B. | 绿色更深 | C. | 变黄 | D. | 无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


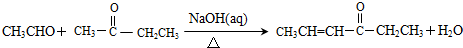
 ,其反应类型是加成反应.
,其反应类型是加成反应.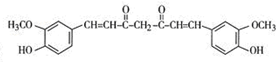 .
.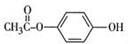 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 文献名称 | 有关Fe(OH)2的描述 |
| 《大学普通化学(下册)》 | 白色沉淀,易被氧化成微绿色Fe3(OH)8 |
| 《化学教育》 | 白色沉淀,在冷水中易形成绿色的水合物Fe(OH)2•nH2O,热水中不易形成水合物 |
| 实验序号 | 实验步骤 | 实验现象 |
| 一 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②保持较高温度,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色絮状沉淀,并能保持一段时间 |
| 二 | ①在试管中加入20mL蒸馏水 ②加入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为灰绿色,最后变为红褐色 |
| 三 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②恢复室温后,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为绿色沉淀 |
| 实验步骤 | 实验现象与结论 |
| ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②迅速用长滴管伸入液面下依次挤入一滴饱和FeSO4 溶液、一滴NaOH溶液 ③将O2缓缓通入白色沉淀中. | 若沉淀中出现绿色的迹象,则假设二成立; 若沉淀中没有出现任何绿色的迹象,则假设二不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
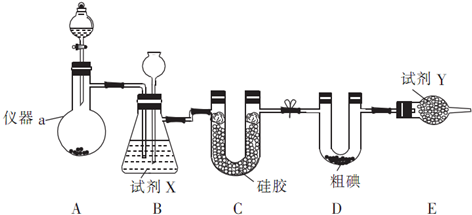
| 滴定次数 | 待测液体积/mL | Na2S2O3标准液体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
| 第三次 | 25.00 | 4.20 | 26.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、H2SO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、H2SO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①②④⑥ | C. | ①②③⑥ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)中H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 | |
| B. | 在反应过程中,溶液的H+浓度不变 | |
| C. | 在反应过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com