
【题目】已知:将C12通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且![]() 的值仅与温度高低有关。当n(NaOH)=6amol时,下列有关说法正确的是
的值仅与温度高低有关。当n(NaOH)=6amol时,下列有关说法正确的是
A.改变温度,反应中转移电子的物质的量n的范围:3amol≤n≤5amol
B.改变温度,产物中NaCl的最小理论产量为4amol
C.参加反应的氯气的物质的量3amol
D.某温度下,若反应后![]() =6,则溶液中
=6,则溶液中![]() =
=![]()
【答案】AC
【解析】
C12与NaOH溶液反应可以按照两种反应进行,①3C12+6NaOH=5NaCl+NaClO3+3H2O,②C12+2NaOH=NaCl+NaClO+H2O;
A.如果按照①反应,转移电子物质的量为5amol,如果按照②反应,转移电子物质的量为3amol,改变温度,反应中转移电子的物质的量n的范围:3amol≤n≤5amol,A正确;
B.按照①进行生成NaCl 5amol,按照②进行生成NaCl 3amol,故生成NaCl的物质的量的范围:3amol~5amol,B错误;
C.根据方程式可知,无论按照哪种反应进行,反应的氯气的物质的量均为3amol,C正确;
D.设按照①进行反应的NaOH的物质的量为xamol,则按照②进行反应的NaOH的物质的量为(6—x)amol,生成的NaCl物质的量为[![]() ]mol,NaClO物质的量为
]mol,NaClO物质的量为![]() mol,NaClO3为
mol,NaClO3为![]() mol,根据
mol,根据![]() =6,解得x=
=6,解得x=![]() ,因此
,因此![]() =6,D错误;
=6,D错误;
答案选AC。


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 124 g P4含有P—P键的个数为4NA B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA D. 60gSiO2中含Si—O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:3Fe+4H2O(g)=Fe3O4+4H2。某化学小组的同学为探究铁与水蒸气的反应,并对所得产物进行检验,设计了如图所示的实验装置(尾气处理等装置已略去)并进行实验。

请回答下列问题:
(1)图中盛放碱石灰的仪器名称为______________。
(2)D装置中观察到的实验现象为_______________________。
(3)从安全角度考虑,实验过程中应先点燃的酒精灯为_____________(填“A”或“D”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①月球上某矿石经处理得到的MgO中含有少量SiO2,用NaOH溶液除去SiO2的化学方程式为______。
②MgO与炭粉和氯气在一定条件下反应可制备MgCl2,尾气中的氯气可用足量冷的NaOH溶液完全吸收,则生成的盐为_________、_________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中氮氧化物和碳氢化合物受紫外线作用可产生一次污染物——光化学烟雾,其中部分物质的反应过程如图所示。下列说法正确的是( )

A.该过程中![]() 作催化剂B.反应过程中没有电子转移
作催化剂B.反应过程中没有电子转移
C.反应过程中氮氧化物不断被消耗D.丙烯转化为甲醛和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:
(实验一)制取NaNO2
该小组先查阅资料知:①2NO+Na2O2→2NaNO2;2NO2+Na2O2→2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如图(夹持装置略去):
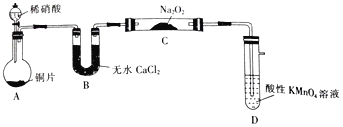
(1)装置D的作用是_______________;如果没有B装置,C中发生的副反应有_______________。
(2)就算在装置气密性良好的情况下进行实验,该小组发现制得的NaNO2的纯度也不高,可能的原因是由_____________;设计一种提高NaNO2纯度的改进措施_________。
(实验二)测定NaNO2样品(含NaNO3杂质)的纯度
先查阅资料知:①5NO2-+2MnO4-+6H+→5NO3-+3Mn2++3H2O;
②MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O
然后,设计如下方案测定样品的纯度:
样品→溶液A ![]() 溶液B
溶液B ![]() 数据处理
数据处理
(3)取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol/L的酸性高锰酸钾溶液在锥形瓶中充分反应.反应后的溶液用0.1000 mol/L (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为_________.
(4)通过上述实验测得样品中NaNO2的纯度偏高,该小组讨论的原因错误的是_________。(填字母编号)
a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列的物理量不再发生变化时,表明反应A(固)+2B(气)![]() C(气)+D(气)已达到平衡状态的是( )
C(气)+D(气)已达到平衡状态的是( )
A. 混合气体的压强 B. 混合气体的密度
C. 气体的总物质的量 D. A的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定为3L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)上述反应涉及三种元素,其中原子半径最大的元素核外电子排布式为_________,原子核外电子运动状态最多的元素是_______(写元素符号)。
(2)上述反应所涉及的四种物质中非极性分子的沸点顺序是_____,其主要原因是_________。
(3)该反应的化学平衡常数表达式为_______;该反应的正方向是________反应(选填“吸热”、放热)
(4)某温度下,2min内生成10.8g H2O(g),用CO浓度变化表示这段时间内的平均反应速率为____________;若平衡时各物质浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为_________℃
(5)能判断该反应是否达到化学平衡状态的依据是_______
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
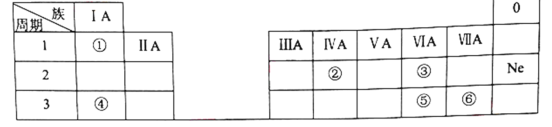
(1)②的元素符号是______。
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤______⑥。
(3)①和③两种元素组成的化合物中含有的化学键为________(填“离子键”或“共价键”)。
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com