
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
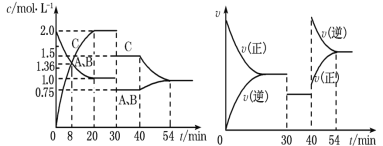
下列说法中正确的是( )
A.30min~40min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30min时降低温度,40min时升高温度
D.8min前A的平均反应速率为0.08mol·L-1·min-1
【答案】D
【解析】
A.由图象可知,30~40 min只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故A错误;
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1,反应前后气体体积不变,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,应是升高温度,则正反应为放热反应,故B错误;
C.由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,故C错误;
D.由图可知8min前A的浓度减小了2molL-1-1.36molL-1=0.64molL-1,所以A的反应速率为![]() =0.08molL-1min-1,故D正确;
=0.08molL-1min-1,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() =1×10-12的溶液中:K+、
=1×10-12的溶液中:K+、![]() 、
、![]() 、
、![]()
C.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.能使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是
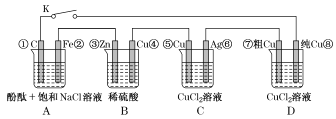
A.当K闭合时,装置A发生吸氧腐蚀,在电路中作电源
B.当K断开时,装置B锌片溶解,有氢气产生
C.当K闭合后,装置C为电镀池,可以实现在银上镀铜
D.当K闭合后,装置D中粗铜电极减少质量与纯铜电极增加的质量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为某有机物与各种试剂的反应现象,则这种有机物可能是
试剂 | 钠 | 溴水 | NaHCO3溶液 |
现象 | 放出气体 | 褪色 | 放出气体 |
A. CH2═CH﹣CH2﹣OHB. ![]()
C. CH2═CH﹣COOHD. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. ![]() 表示质子数为6、中子数为8的核素
表示质子数为6、中子数为8的核素
B. 甲醇(CH3OH)和甘油(![]() )互为同系物
)互为同系物
C. C5H12的同分异构体有3种,其沸点各不相同
D. CH3CH2CH2CH(CH3)2的名称是2-甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是
A.淀粉![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B.纤维素![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C.油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下列信息,完成填空:
(1)某单质位于短周期,是一种常见的半导体材料。在25℃、101kPa下,其气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190.0kJ,该反应的热化学方程式是___。
(2)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ·mol-1,2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ·mol-1,则反应: Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为___。
(3)在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
化学方程式 | K(t1) | K(t2) |
F2+H22HF | 1.8×1036 | 1.9×1032 |
Cl2+H22HCl | 9.7×1012 | 4.2×1011 |
Br2+H22HBr | 5.6×107 | 9.3×106 |
I2+H22HI | 43 | 34 |
①已知t2>t1,生成HX的反应是___反应(填“吸热”或“放热”)。
②K的变化体现出X2化学性质的递变性,用原子结构解释原因:___,原子半径逐渐增大,得电子能力逐渐减弱。
③在t1温度1L恒容密闭容器中,1molI2(g)和1molH2反应达平衡时热量变化值为Q1;反之,2molHI分解达平衡时热量变化值为Q2,则:Q1___Q2(填“>”“<”“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物甲只含C、H两种元素,化合物乙和丙都只含C、H、F三种元素,甲、乙、丙都是饱和化合物且分子中都含有26个电子。据此推断:
(1)甲的分子式是________;若甲分子中有两个H原子被F原子代替,所得产物可能有________种结构。
(2)乙是性能优异的环保产品,它可替代某些会破坏臭氧层的氟里昂产品,用作制冷剂。已知乙分子中C、H、F原子个数比为1:2:2,则乙的电子式是________;下列对于乙的描述正确的是________。
A.其分子构型为正四面体 B.其分子构型为正四边形
C.具有两种同分异构体 D.没有同分异构体
(3)将甲、乙按物质的量之比1:1混合所得混合物的平均摩尔质量等于丙的摩尔质量,则丙的分子式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com