
【题目】电石和水发生反应生成乙炔的化学方程式为![]() ,通过下列某些实验装置制取、净化、检验乙炔气体,并通过测定乙炔的物质的量计算电石的纯度。请回答下列问题。
,通过下列某些实验装置制取、净化、检验乙炔气体,并通过测定乙炔的物质的量计算电石的纯度。请回答下列问题。
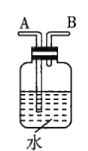
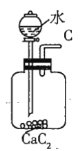
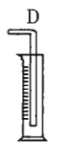
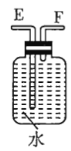
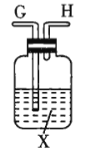
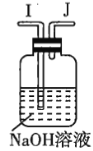
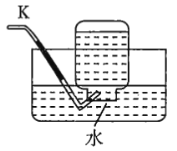
注:![]() 为
为![]() 溴的
溴的![]() 溶液,其中
溶液,其中![]() 的质量分数为3.2%。
的质量分数为3.2%。
(1)若用上述仪器和导管组装实验装置,试从图中选用几种必要的装置,并把它们连成一套装置,则被选用装置的接口编号连接顺序是__________。
(2)若该实验产生的气体有难闻的臭鸡蛋气味,说明产生的气体中含有杂质______(填化学式),检验此杂质的化学反应方程式为_________。
(3)假设用![]() 的电石与水反应后,溴的
的电石与水反应后,溴的![]() 溶液中的
溶液中的![]() 恰好被完全反应,生成
恰好被完全反应,生成![]() ,测得排入量筒内液体的体积为
,测得排入量筒内液体的体积为![]() (标准状况下),则该电石纯度的计算式为_______________。
(标准状况下),则该电石纯度的计算式为_______________。
【答案】![]()
![]()
![]() (合理即可)
(合理即可) 
【解析】
(1)解答时需要考虑气体制备装置、气体净化装置、气体检验装置和排水法测气体体积的装置,据此来选择仪器;
(2)电石制乙炔时,产物中往往有杂质![]() ,这是一种难闻的有臭鸡蛋气味的气体;
,这是一种难闻的有臭鸡蛋气味的气体;
(3)首先根据题干给出的信息计算溴的物质的量,而1分子乙炔在加成时可以消耗2分子溴,因此得出乙炔的物质的量;根据![]() 不难看出乙炔和电石的物质的量之比为1:1,代入其摩尔质量来计算纯度(质量分数)即可。
不难看出乙炔和电石的物质的量之比为1:1,代入其摩尔质量来计算纯度(质量分数)即可。
(1)该实验需要的装置依次为气体制备装置、气体净化装置(除硫化氢)、气体检验装置、排水法测气体体积的装置,故所选用装置接口的连接顺序为![]() ;
;
(2)电石中含有硫化物,与水反应生成有臭鸡蛋气味的硫化氢气体,检验![]() 可以用硫酸铜溶液,会产生黑色沉淀,其化学方程式为
可以用硫酸铜溶液,会产生黑色沉淀,其化学方程式为![]() ;
;
(3)溴的![]() 溶液中的
溶液中的![]() 恰好被完全反应生成
恰好被完全反应生成![]() ,则
,则![]() 的物质的量为
的物质的量为![]() ,则消耗的乙炔的物质的量为
,则消耗的乙炔的物质的量为![]() ,测得排入量筒内液体体积为
,测得排入量筒内液体体积为![]() (标准状况下),则收集到的乙炔的体积为
(标准状况下),则收集到的乙炔的体积为![]() ,其物质的量为
,其物质的量为![]() ,所以乙炔的总物质的量为
,所以乙炔的总物质的量为![]() ,由
,由![]() 可知,
可知,![]() 的物质的量为
的物质的量为![]() ,所以该电石纯度的计算式为
,所以该电石纯度的计算式为 。
。


科目:高中化学 来源: 题型:
【题目】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
元素 | A | B | C | D |
性质或结构信息 | 单质制成的高压灯发出的黄光透雾力强、射程远 | 工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构 | 单质在常温、常压下是气体,原子的 | 2价阳离子的核外电子排布与氖原子相同 |
(1)A与Cl形成的化合物为__________(填“离子”或“共价”)化合物,含有__________键。
(2)D和C形成的化合物中含有__________键。写出C单质与水反应的化学方程式:____________________。
(3)下列对元素B及元素B的常见单质描述正确的是__________(填序号)。
a.B元素的最高正价为+6
b.常温、常压下B的常见单质难溶于水
c.B的常见单质分子中含有18个电子
d.在一定条件下镁条能与B的常见单质反应
(4)若B与H能形成![]() ,则B为__________元素,
,则B为__________元素,![]() 中含有的化学键为__________。
中含有的化学键为__________。
(5)A和D两元素中金属性较强的是__________(写元素符号),写出能证明该结论的一个实验事实:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比c(B)/c(C) 将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质, A、C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色________。(填“变浅”“变深”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
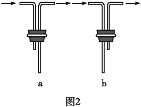
【题目】ClO2(黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。
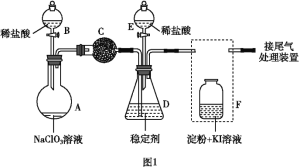
(1)仪器A的名称是_______________________。
(2)安装F中导管时,应选用图2中的___________________。
(3)A中发生反应生成ClO2和Cl2,其氧化产物和还原产物物质的量之比为__________。
(4)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是__________________。
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为____。
(6)ClO2很不稳定,需随用随制,产物用水吸收可得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样,量取V0 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V1 mL。
(已知2ClO2+10I+8H+=2Cl+5I2+4H2O 2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
计算该ClO2的浓度为______g/L(用含字母的代数式表示,计算结果化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物W的结构简式为![]() 下列有关W的说法错误的是
下列有关W的说法错误的是
A.是一种酯类有机物B.含苯环和羧基的同分异构体有3种
C.所有碳原子可能在同一平面D.能发生取代、加成和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时将10mLpH=11的氨水加水稀释至100mL,下列判断正确的是
A.稀释后溶液的pH=7B.氨水的电离度增大,溶液中所有离子的浓度均减小
C.稀释过程中![]() 增大D.pH = 11氨水的浓度为0.001mol/L
增大D.pH = 11氨水的浓度为0.001mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经过下列操作,能将化合物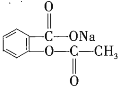 转变为
转变为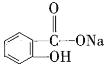 的有( )
的有( )
①跟足量NaOH溶液共热后,通入二氧化碳直至过量
②与稀硫酸共热后,加入足量Na2CO3溶液
③与稀硫酸共热后,加入足量NaOH溶液
④与稀硫酸共热后,加入足量NaHCO3溶液
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料。氯化氢催化氧化制氯气的化学方程式为4HCl+O2  2Cl2 +2H2O。
2Cl2 +2H2O。
(1)作为氧化剂的物质是______。氯元素的化合价______(填“升高”或“降低”)。
(2)若反应中消耗了4mol HCl,则生成Cl2的物质的量为 ______mol,转移电子的物质的量为______ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,在20.0mL 0.10mol/LH2SO4溶液中滴入0.10 mol/L的NaOH溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列叙述正确的是
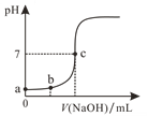
A.滴定过程最好用甲基橙作指示剂
B.a点溶液的pH=1.0
C.b点溶液中c(H+)=0.05mol/L
D.c点对应的NaOH溶液体积为20.0mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com