
【题目】黑火药是中国古代四大发明之一,它的爆炸反应为:
2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)生成物A的电子式为:__________________,属于______________晶体。
(2)黑火药中位于短周期的元素有_________种。其中有一种元素的单质可制药,其氧化物可做防腐剂,该元素在周期表中的位置是_________,该元素的原子核外有_______种不同运动状态的电子。
(3)黑火药所含元素中原子半径从大到小的顺序是______________(用元素符号表示);
(4)下列能说明黑火药中碳与硫两元素非金属性相对强弱的有___________________。
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价 D.加热分解温度:CH4>H2S
【答案】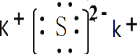 离子 四 第三周期第VIA族 16 K>S>C>N>O AC
离子 四 第三周期第VIA族 16 K>S>C>N>O AC
【解析】
(1)由原子守恒可知,A为K2S,为离子化合物;
(2)C、N、O、S、K中,氧化物可用于漂白织物和防腐剂,为S的氧化物,S的原子核外电子数为16;
(3)电子层越多,半径越大;同周期原子序数大的半径小;
(4)A.元素最高价氧化物对应水化物的酸性越强,则元素的非金属性越强;
B.亚硫酸不是硫元素的最高价氧化物对应的水化物;
C.非金属性强的元素显示负价,非金属性弱的则显示正价;
D.一般来说,元素的气态氢化物越稳定,则元素的非金属性越强。
(1)由原子守恒可知,A为K2S,只含离子键,为离子晶体,其电子式为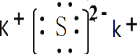 ;
;
(2)黑火药中位于短周期的元素有C、N、O、S,氧化物可用于漂白织物和防腐剂,为S的氧化物,S位于第三周期第VIA族,S的原子核外电子数为16,则有16种不同运动状态的电子;
(3)电子层越多,半径越大;同周期原子序数大的半径小,则原子半径由大到小为K>S>C>N>O;
(4)A.Na2CO3水解呈碱性,说明H2CO3是弱酸,Na2SO4不水解,H2SO4是强酸,所以H2SO4的酸性强于H2CO3的,则能说明碳与硫两元素非金属性为S>C,故A选;
B.亚硫酸强于碳酸,说明亚硫酸电离出氢离子的能力强于硫酸,不能说明碳与硫两元素非金属性相对强弱,故B不选;
C.直接说明S的非金属性强于C,所以S才显负价,碳元素显示正价,故C选;
D.氢化物的稳定性顺序是CH4>H2S,但S的非金属性强于碳元素,故D不选;
故答案为:AC。


科目:高中化学 来源: 题型:
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________:
(2)过程I 加入铁屑的主要作用是___________,分离得到固体的主要成分是______,从固体中分离出铜需采用的方法是___________________;
(3)过程II中发生反应的化学方程式为_________________________;
(4)过程II中调节溶液的pH为5,金属离子浓度为__________________。(列式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
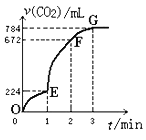
A.F点收集到的CO2的量最多
B.OE段表示的平均速率最快
C.EF段用盐酸表示该反应的平均反应速率为0.4mol·L-1min-1
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
①升高温度________;
②加入催化剂________;
③充入更多的H2________;
④保持容器中压强不变,充入氖气________;
⑤保持容器容积不变,通入氖气________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:①2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
②C3H8(g)+5O2(g)=3CO2(g) +4H2O(g) △H=-2044.0kJ·mol-1
(1)氢气的燃烧热是__________
(2)已知:H2O(l)=H2O(g) △H=+44.0kJ·mol-1,写出丙烷(C3H8)燃烧生成二氧化碳和液态水的热化学方程式:__________
(3)实验测得H2和C3H8的混合气体共3mol,完全燃烧生成液态水时放热2791.6kJ,计算混合气体中H2和C3H8的体积比是_____
(4)恒温恒容条件下,硫可以发生如下反应,其反应过程和能量关系如图所示,已知2SO2(g)+O2(g)=2SO3(g) △H=-196.6kJ·mol-1
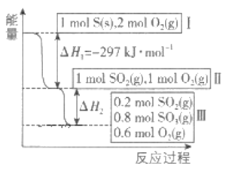
①写出能表示硫的燃烧热的热化学方程式:__________
②△H2=__________kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。某学生拟用下图装置做草酸晶体的分解实验并验证部分产物,下列说法错误的是
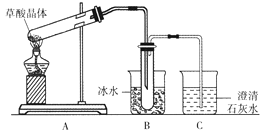
A. 装置A中的大试管口应略向下倾斜,是因为加热草酸晶体时会产生水
B. 装置B的主要作用是冷凝(水蒸气、草酸)等,防止草酸进入装置C中,干扰CO2的检验
C. 装置C中可观察到的现象是有气泡冒出,澄清石灰水变浑浊
D. 本实验能证明草酸晶体的分解产物有二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D存在下图转化关系(部分生成物和反应条件略去)。下列物质中符合转化关系的A的个数为A![]() B
B![]() C,①Cl2 ②S ③Fe ④NH3 ⑤AlCl3 ⑥Na2CO3
C,①Cl2 ②S ③Fe ④NH3 ⑤AlCl3 ⑥Na2CO3
A.3B.4C.5D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是

A. 水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键所致
B. 乳酸(![]() )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=_____。已知:K(300℃)>K(350℃),则该反应正反应是_________热反应。升高温度,正反应速率_______(填“增大”、“减小”或“不变”)。
(2)下图中表示NO2的变化的曲线是____。用O2表示从0~2 s内该反应的平均速率v(O2)=______。
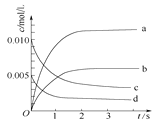
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com