
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________:
(2)过程I 加入铁屑的主要作用是___________,分离得到固体的主要成分是______,从固体中分离出铜需采用的方法是___________________;
(3)过程II中发生反应的化学方程式为_________________________;
(4)过程II中调节溶液的pH为5,金属离子浓度为__________________。(列式计算)
【答案】2Fe3++Cu = 2Fe2++Cu2+ )回收铜 Cu和Fe 加盐酸反应后过滤 FeCl2+Ca(OH)2 =Fe(OH)2↓+CaCl2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Ksp=c(Fe3+)·c3(OH-),pH为5,c(H+)=10-5,c(OH-)=![]() =10-9mol/L,所以c(Fe3+)=
=10-9mol/L,所以c(Fe3+)=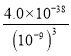 = 4.0×10-11 (mol/L)
= 4.0×10-11 (mol/L)
【解析】
(1)氯化铁和铜反应生成氯化亚铁和氯化铜,依据离子方程式书写方法写出;
(2)过程Ⅰ加入铁屑的主要作用是和氯化铜发生反应生成铜,过滤后得到固体为Fe和Cu,加入盐酸铁反应,铜不反应过滤分离得到铜;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;
(4)过程Ⅱ中调节溶液的pH为,氢氧化铁沉淀溶液中存在沉淀溶解平衡,依据溶度积常数计算。由Ksp=c(Fe3+)·c3(OH-),c(OH-)=![]() ,可求得c(Fe3+)。
,可求得c(Fe3+)。
(1)FeCl3蚀刻铜箔反应是三价铁离子具有氧化性和铜反应生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)向废液中投入过量铁屑,铁会和三氯化铁溶液反应生成氯化亚铁,和氯化铜反应生成铜和氯化亚铁,所以加入铁粉是为了得到铜,过滤得到固体是过量的铁和铜,用盐酸溶解铁反应,铜不反应过滤得到铜;
故答案为:回收铜;铁和铜;加盐酸反应后过滤;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;反应的化学方程式为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 ,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)过程Ⅱ中调节溶液的pH为5,常温下溶液中氢氧根离子浓度为10-9mol/L,依据溶度积常数计算铁离子浓度,Fe(OH)3(s)Fe3++3OH-;Ksp=c(Fe3+)×c3(OH-);c(H+)=10-5,c(OH-)=![]() =10-9mol/L,c(Fe3+)=
=10-9mol/L,c(Fe3+)=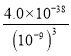 =4×10-11mol/L;
=4×10-11mol/L;
故答案为:4×10-11mol/L。


科目:高中化学 来源: 题型:
【题目】雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如下(Ce为铈元素):

下列说法错误的是
A.Na2S2O4中S元素的化合价为+3
B.装置Ⅱ消耗36 g 水生成4 NA个H+(NA代表阿伏伽德罗常数)
C.装置Ⅲ用甲烷燃料电池进行电解,当消耗24 g 甲烷时,理论上可再生10 mol Ce4+
D.装置Ⅳ获得粗产品NH4NO3的实验操作依次为蒸发浓缩、冷却结晶、过滤、洗涤等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室进行下列有关的物质制备中,理论上正确、操作上可行、经济上合理的是
A.C![]() CO
CO![]() CO2
CO2![]() Na2CO3
Na2CO3
B.Cu![]() Cu(NO3)2溶液
Cu(NO3)2溶液![]() Cu(OH)2
Cu(OH)2
C.Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3溶液
Fe2(SO4)3溶液
D.CaO![]() Ca(OH)2溶液
Ca(OH)2溶液![]() NaOH溶液
NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2中的c(NH![]() )________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH
)________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是___________________;
②20℃时,0.1 mol/L NH4Al(SO4)2中2c(SO![]() )-c(NH
)-c(NH![]() )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
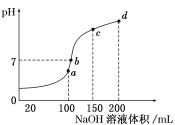
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
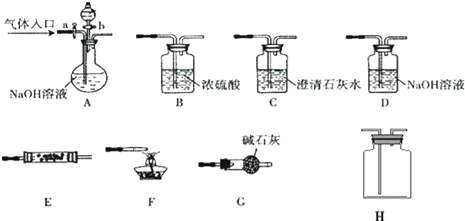
(1)实验前,如何检查A装置的气密:__。
(2)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为__(填代号)。能验证CO氧化产物的现象是__。
(3)若A中气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,H为空瓶,D中改为石蕊试液,按A→G→E→H→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①实验中先用酒精灯加热催化管,再通入混合气体,可观察到H内有红棕色气体出现,D中石蕊试液变红,则E中发生反应的方程式为__。
②若把酒精灯撤去,继续通入气体,催化剂可继续保持红热状态,反应继续进行.能使催化剂继续保持红热的原因是:__。
③某同学在做上述实验时出现了与其他同学不同的现象,他发现催化剂红热现象明显而正常,但石蕊试液不变红.请分析可能的原因:(答1点即可)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:

关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
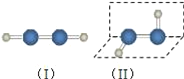
【题目】过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:
(1)过氧化氢的分子结构如图(Ⅱ),则过氧化氢属于__(极性/非极性)分子.过去曾经有人认为过氧化氢的分子结构也可能是(Ⅰ),选择合理实验方法证明过氧化氢的分子结构为(Ⅱ)__(选填编号).
a.测定过氧化氢的沸点
b.测定过氧化氢分解时的吸收的能量
c.测定过氧化氢中H﹣O和O﹣O的键长
d.观察过氧化氢细流是否在电场中偏转
Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢.实验室可用稀硫酸和过氧化物在用冰冷却的条件下反应制取过氧化氢.
(2)上述过氧化物中最适合的是__,反应完毕后__(填操作名称)即可得到双氧水.
(3)若反应时没有用冰冷却,会有气体产生,写出反应的化学方程式__.用酸性高锰酸钾溶液滴定双氧水的方法可以测定双氧水的浓度.
(4)取5.00mL 双氧水样品,配制成250mL溶液.此实验过程必须用到的两种主要仪器为__(填仪器名称).
(5)取25.00mL上述溶液,用0.020mol/L的酸性高锰酸钾溶液滴定,看到__,到达滴定终点,消耗高锰酸钾溶液15.50mL.则原双氧水样品中含过氧化氢__ g/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸是合成阿斯匹林的重要原料.水杨酸的学名邻羟基苯甲酸,结构简式为![]() ,请回答下列问题:
,请回答下列问题:
(1)请写出水杨酸中除苯环外具有的官能团__.
(2)请写出与水杨酸互为同分异构体,既属于酚类又属于醛类化合物的结构简式(写一种即可):__.
(3)水杨酸的另一种同分异构体的结构简式为![]() ,1mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)__;
,1mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)__;
A.1mol B.2mol C.3mol D.4mol.
(4)已知有机物CH3COOH可以表示为:![]() ,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为:
,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为: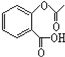 ,则阿斯匹林的分子式为__.
,则阿斯匹林的分子式为__.
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(只选一种试剂即可)__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是中国古代四大发明之一,它的爆炸反应为:
2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)生成物A的电子式为:__________________,属于______________晶体。
(2)黑火药中位于短周期的元素有_________种。其中有一种元素的单质可制药,其氧化物可做防腐剂,该元素在周期表中的位置是_________,该元素的原子核外有_______种不同运动状态的电子。
(3)黑火药所含元素中原子半径从大到小的顺序是______________(用元素符号表示);
(4)下列能说明黑火药中碳与硫两元素非金属性相对强弱的有___________________。
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价 D.加热分解温度:CH4>H2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com