
����Ŀ������������Ӧ�ù㷺������ɫ���������������������ȶ������Ի��������������ֽ⣮��գ�
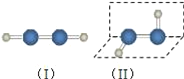
��1����������ķ��ӽṹ��ͼ�����������������__������/�Ǽ��ԣ����ӣ���ȥ����������Ϊ��������ķ��ӽṹҲ�����ǣ���ѡ�����ʵ�鷽��֤����������ķ��ӽṹΪ����__��ѡ���ţ���
a���ⶨ��������ķе�
b���ⶨ��������ֽ�ʱ�����յ�����
c���ⶨ����������H��O��O��O�ļ���
d���۲��������ϸ���Ƿ��ڵ糡��ƫת
Na2O2��K2O2�Լ�BaO2���������������ɹ������⣮ʵ���ҿ���ϡ��������������ñ���ȴ�������·�Ӧ��ȡ�������⣮
��2�������������������ʺϵ���__����Ӧ��Ϻ�__����������ƣ����ɵõ�˫��ˮ��
��3������Ӧʱû���ñ���ȴ���������������д����Ӧ�Ļ�ѧ����ʽ__�������Ը��������Һ�ζ�˫��ˮ�ķ������Բⶨ˫��ˮ��Ũ�ȣ�
��4��ȡ5.00mL ˫��ˮ��Ʒ�����Ƴ�250mL��Һ����ʵ����̱����õ���������Ҫ����Ϊ__�����������ƣ���
��5��ȡ25.00mL������Һ����0.020mol/L�����Ը��������Һ�ζ�������__������ζ��յ㣬���ĸ��������Һ15.50mL����ԭ˫��ˮ��Ʒ�к���������__ g/L��
���𰸡����� d BaO2 ���� 2BaO2+2H2SO4=2BaSO4+O2��+2H2O ��ʽ�ζ��ܡ�250mL����ƿ ��Һ��dz�Ϻ�ɫ�Ұ�����ڲ���ɫ 52.7g/L
��������
��1���ɼ��Լ����ɵķ��ӣ����ṹ���Գƣ�����������IJ��ص���Ϊ���Է��ӣ����Է���ϸҺ���ڵ糡�лᷢ��ƫת��
��2��������Ŀ��Ϣ��ʵ����ͨ������ij�ֹ�������������ϡ�������ã����˺��Ƶýϴ�����H2O2��Һ��˵����һ�ֲ���Ϊ������
��3��BaO2�����ᷴӦ�������ᱵ��������ˮ��
��4��˫��ˮ����ǿ����������ʽ�ζ�����ȡ������250mL��Һ��Ҫ250mL����ƿ��
��5�����Ը��������ҺΪ��ɫ���ﵽ�ζ��յ�ʱ��Һ��dz�Ϻ�ɫ�Ұ�����ڲ���ɫ�����ݷ�Ӧ����ʽ����25mL��Һ��˫��ˮ�����ʵ�����Ȼ������������������1L��Һ�е�˫��ˮ��������
��1��H2O2�����к������⼫�Թ��ۼ��������Ǽ��Թ��ۼ����ɼ��Լ����ɵķ��ӣ����ṹ���Գƣ�����������IJ��ص���Ϊ���Է��ӣ����Է���ϸҺ���ڵ糡�лᷢ��ƫת��
a.���ӵ��۷е�����Ӽ��������йأ�������Ƿ�Գ��أ���a����
b.��������ֽ�ʱ���յ��������������ļ����йأ�������Ƿ�Գ��أ���b����
c.ͼʾ���ֽṹ��������������е�����������������������ͬ�������𣬹�c����
d.ͼʾ���ֽṹ������1Ϊ�Գƽṹ�ķǼ��Է��ӣ�����2Ϊ�ǶԳƽṹ�ļ��Է��ӣ����Է���ϸҺ���ڵ糡�з���ƫת���Ǽ��Է���ϸҺ���ڵ糡�в�����ƫת���۲��������ϸҺ���ڵ糡���Ƿ���ƫת����ȷ���²�����һ����ȷ����d��ȷ��
�ʴ�Ϊ�����ԣ�d��
��2��ʵ����ͨ������ij�ֹ�������������ϡ�������ã����˺��Ƶýϴ�����H2O2��Һ��˵����һ�ֲ���Ϊ�����������������ᱵ����������ѡ��BaO2����Ӧ���ɹ�����������ᱵ���������˼��ɵõ������Ĺ������⣻
�ʴ�Ϊ��BaO2�����ˣ�
��3��������Ӧʱû���ñ���ȴ��������������������ɵ���������BaO2�����ᷴӦ�������ᱵ��������ˮ���䷴Ӧ�Ļ�ѧ����ʽΪ��2BaO2+2H2SO4��2BaSO4+O2��+2H2O��
�ʴ�Ϊ��2BaO2+2H2SO4��2BaSO4+O2��+2H2O��
��4��˫��ˮ����ǿ����������ʽ�ζ�����ȡ������250mL��Һ��Ҫ250mL����ƿ������ȡ5.00mL ˫��ˮ��Ʒ�����Ƴ�250mL��Һ��ʵ����̱����õ���������Ҫ����Ϊ��ʽ�ζ��ܡ�250 mL����ƿ��
�ʴ�Ϊ����ʽ�ζ��ܡ�250 mL����ƿ��
��5�����Ը��������ҺΪ��ɫ���ﵽ�ζ��յ�ʱ˫��ˮ��ȫ��Ӧ����Һ��Ϊdz�Ϻ�ɫ�Ұ�����ڲ���ɫ����Ӧ���ӷ���ʽ�ǣ�2MnO4��+5H2O2+6H+��2Mn2++5O2��+8H2O��n(MnO4��)��cV��0.020mol/L��0.0155L��3.10��10��4mol��n(H2O2)��![]() n(MnO4��)��
n(MnO4��)��![]() ��3.10��10��4mol����25.00mL������Һ��˫��ˮ��������m(H2O2)��nM��
��3.10��10��4mol����25.00mL������Һ��˫��ˮ��������m(H2O2)��nM��![]() ��3.10��10��4mol��34g/mol��2.635��10��2g����250mL��Һ�к���m(H2O2)= 2.635��10��1g������1000mL��1L˫��ˮ��Ʒ��Һ��˫��ˮ��������m(H2O2)��2.635��10��1g��
��3.10��10��4mol��34g/mol��2.635��10��2g����250mL��Һ�к���m(H2O2)= 2.635��10��1g������1000mL��1L˫��ˮ��Ʒ��Һ��˫��ˮ��������m(H2O2)��2.635��10��1g��![]() ��52.7g������ԭ˫��ˮ��Ʒ�к���������52.7g/L��
��52.7g������ԭ˫��ˮ��Ʒ�к���������52.7g/L��
�ʴ�Ϊ����Һ��dz�Ϻ�ɫ�Ұ�����ڲ���ɫ��52.7��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��������»�ѧ��Ӧ��2SO2(g)��O2(g)![]() 2SO3(g) ��H��-QkJ��mol��1�������������·ֱ���������ͷ�Ӧ�ų�������(Q)������У�
2SO3(g) ��H��-QkJ��mol��1�������������·ֱ���������ͷ�Ӧ�ų�������(Q)������У�
���� | SO2��mol�� | O2��mol�� | N2��mol�� | Q��kJ�� |
�� | 2 | 1 | 0 | Q1 |
�� | 1 | 0.5 | 0 | Q2 |
�� | 1 | 0.5 | 1 | Q3 |
�����������ݣ�����������ȷ���ǣ� ��
A.�����������·�Ӧ����1molSO3�������![]() kJ
kJ
B.2Q1��2Q2��Q1��Q
C.Q1��2Q2��2Q3��Q
D.2Q2��2Q3��Q1��Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷�(FeSO4��7H2O)�ڻ�ѧ�ϳ���������ԭ������������ҵ�ϳ��÷���м����һ��Ũ�ȵ�������Һ�Ʊ��̷���
(1)98% 1.84g/cm3��Ũ������ϡ�����У��ܶ��½�����ϡ����50%ʱ���ܶ�Ϊ1.4g/cm3��50%���������ʵ���Ũ��Ϊ________(������λС��)��50%��������30%������������ϣ�������Ũ��Ϊ_______(��>��<��=)40%��
(2)��111.2g�̷���FeSO47H2O��ʽ��Ϊ278���ڸ����¼��ȣ���ַ�Ӧ������Fe2O3�����SO2��SO3��ˮ�Ļ�����壬������Fe2O3������Ϊ_______g��SO2Ϊ_______mol��ʵ���ҿ������·����Ʊ�Ħ���ξ���[(NH4)2SO4��FeSO4��6H2O��ʽ��Ϊ392]��
(3)��4.88g��м(��Fe2O3)��25mL 3mol/L H2SO4��ַ�Ӧ�õ�FeSO4��H2SO4�Ļ����Һ��ϡ����Һ��100mL�������pH=1����м��Fe2O3������������________��������λС������
(4)������100mL��Һ�м��������Һ��FeSO4�����ʵ�����(NH4)2SO4���壬��������ȫ�ܽ������������ˮ����ȴ��t�棬����Ħ���ξ���12.360g��ʣ����Һ������Ϊ82.560g��t��ʱ������(NH4)2SO4��FeSO4��6H2O���ܽ�ȡ�_______��������λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeCl3��Һʴ��ͭ�������·��Ĺ����У���Һ��������Դ���յĹ��̼������£�
I�����Һ��Ͷ�������м����ַ�Ӧ�������������Һ��
II������Һ�м���һ����ʯ��ˮ��������ҺpH��ͬʱ���������Ŀ�����
��֪��Ksp[Fe(OH)3]= 4.0��10-38
�ش��������⣺
(1)FeCl3ʴ��ͭ����Ӧ�����ӷ���ʽΪ______________________________��
(2)����I ������м����Ҫ������___________������õ��������Ҫ�ɷ���______���ӹ����з����ͭ����õķ�����___________________��
(3)����II�з�����Ӧ�Ļ�ѧ����ʽΪ_________________________��
(4)����II�е�����Һ��pHΪ5����������Ũ��Ϊ__________________��(��ʽ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��л������������ȷ���ǣ�������
A.CH3��CH�TCH��CH3 ����ϩ
B.CH3OOCC2H5 ��������
C.![]() 2������3������
2������3������
D.![]() ���ȼױ�
���ȼױ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȷ����
A.CH2BrCH2Br��1��2����������
B.![]() ��2���һ�����
��2���һ�����
C.![]() ��3������
��3������
D.![]() ��������
��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���밴Ҫ��ش��������⣺
(1)ij��̬�л���������������ܶ�Ϊ14������ṹ��ʽΪ____________��
(2)ij�л���Ľṹ��ʽ��ͼ��ʾ������һ�ȴ��ﹲ��_______�֡�
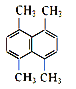
(3)��������ϵͳ����������ӦΪ_______��
(4)�ֱ����ʵ�����C3H8��C4H8��ȫȼ�գ������������������______(�����ʽ)��
(5)�������ʽ�У�ֻ�ܴ���һ���л������________(ѡ���Ӧ�����)��
��CH3 ��CH2 ��CH2O ��CH4O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ô�����CaCO3��100mLϡ���ᷴӦ��ȡCO2��ʵ����̼�¼��ͼ��ʾ(CO2�����������Ϊ��״���µ����)�����з�����ȷ���ǣ� ��
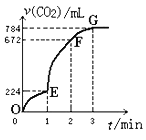
A.F���ռ�����CO2�������
B.OE�α�ʾ��ƽ���������
C.EF���������ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ0.4mol��L-1min-1
D.OE��EF��FG�����У��÷�Ӧ�ö�����̼��ʾ��ƽ����Ӧ����֮��Ϊ2��6��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������A��B��C��D������ͼת����ϵ(����������ͷ�Ӧ������ȥ)�����������з���ת����ϵ��A�ĸ���ΪA![]() B
B![]() C����Cl2 ��S ��Fe ��NH3 ��AlCl3 ��Na2CO3
C����Cl2 ��S ��Fe ��NH3 ��AlCl3 ��Na2CO3
A.3B.4C.5D.6
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com