
【题目】请按要求回答下列问题:
(1)某气态有机物相对于氢气的密度为14,则其结构简式为____________。
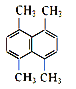
(2)某有机物的结构简式如图所示,则其一氯代物共有_______种。
(3)新戊烷用系统命名法命名应为_______。
(4)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是______(填分子式)。
(5)下列最简式中,只能代表一种有机物的有________(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
【答案】CH2=CH2 2 2,2-二甲基丙烷 C4H8 ①④
【解析】
(1)利用阿伏加德罗定律的推论,计算有机物的摩尔质量,结合相对分子质量分析气态有机物的分子结构;
(2)根据位置判断等效H的种类,以此可确定有机物的一氯代物种类,以此解答该题;
(3)根据新戊烷的结构式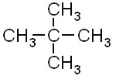 分析命名;
分析命名;
(4)相同物质的量的烃CxHy完全燃烧,耗氧量取决于(x+![]() ),(x+
),(x+![]() )的值越大,耗氧量越多,据此判断;
)的值越大,耗氧量越多,据此判断;
(5)根据有机物中碳原子的饱和度分析判断;
(1)根据阿伏伽德罗定律的推论,同温同压下,气体的密度之比等于其摩尔质量之比。该气体有机物相对氢气的密度为14,则气体的摩尔质量=14×2g/mol=28g/mol,即相对分子质量为28,气态烃的衍生物中甲醛的相对分子质量最小,为30,则该气态有机物为烃类,气态烃中相对分子质量为28的只有乙烯,故结构简式为CH2=CH2;
(2)有机物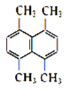 的等效氢如图:
的等效氢如图: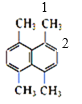 ,则有机物的一氯代物有2种;
,则有机物的一氯代物有2种;
(3)新戊烷的结构简式为: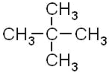 用系统命名法命名应为2,2-二甲基丙烷;
用系统命名法命名应为2,2-二甲基丙烷;
(4)相同物质的量的烃CxHy完全燃烧,耗氧量取决于(x+![]() ),(x+
),(x+![]() )的值越大,耗氧量越多,1molC3H8完全燃烧时的耗氧量为3+
)的值越大,耗氧量越多,1molC3H8完全燃烧时的耗氧量为3+![]() =5mol;1mol C4H8完全燃烧时的耗氧量为4+
=5mol;1mol C4H8完全燃烧时的耗氧量为4+![]() =6mol,故耗氧量多的为C4H8;
=6mol,故耗氧量多的为C4H8;
(5)最简式为CH3的烃其化学式一定为C2H6,CH4O的化学式为CH3OH,因为此时氢原子或其他原子数已经使碳原子达“饱和”状态,而其他选项的最简式,不知道相对原子质量,无法确定分子式,则能确定分子式的为①④。


科目:高中化学 来源: 题型:
【题目】2015年12月31日,日本获得第113号元素的正式命名权.这种原子(记作![]() ),是由30号元素Zn,连续轰击83号元素Bi获得的.下列说法,不正确的是
),是由30号元素Zn,连续轰击83号元素Bi获得的.下列说法,不正确的是
A.获得新核素![]() 的过程,是一个化学变化
的过程,是一个化学变化
B.题中涉及的三种元素,都属于金属元素
C.这种超重核素![]() 的中子数与质子数只差为52
的中子数与质子数只差为52
D.这种新核素,是同主族元素中原子半径最大的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
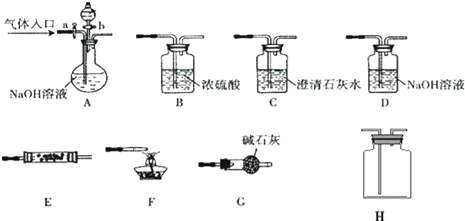
(1)实验前,如何检查A装置的气密:__。
(2)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为__(填代号)。能验证CO氧化产物的现象是__。
(3)若A中气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,H为空瓶,D中改为石蕊试液,按A→G→E→H→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①实验中先用酒精灯加热催化管,再通入混合气体,可观察到H内有红棕色气体出现,D中石蕊试液变红,则E中发生反应的方程式为__。
②若把酒精灯撤去,继续通入气体,催化剂可继续保持红热状态,反应继续进行.能使催化剂继续保持红热的原因是:__。
③某同学在做上述实验时出现了与其他同学不同的现象,他发现催化剂红热现象明显而正常,但石蕊试液不变红.请分析可能的原因:(答1点即可)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:
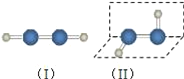
(1)过氧化氢的分子结构如图(Ⅱ),则过氧化氢属于__(极性/非极性)分子.过去曾经有人认为过氧化氢的分子结构也可能是(Ⅰ),选择合理实验方法证明过氧化氢的分子结构为(Ⅱ)__(选填编号).
a.测定过氧化氢的沸点
b.测定过氧化氢分解时的吸收的能量
c.测定过氧化氢中H﹣O和O﹣O的键长
d.观察过氧化氢细流是否在电场中偏转
Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢.实验室可用稀硫酸和过氧化物在用冰冷却的条件下反应制取过氧化氢.
(2)上述过氧化物中最适合的是__,反应完毕后__(填操作名称)即可得到双氧水.
(3)若反应时没有用冰冷却,会有气体产生,写出反应的化学方程式__.用酸性高锰酸钾溶液滴定双氧水的方法可以测定双氧水的浓度.
(4)取5.00mL 双氧水样品,配制成250mL溶液.此实验过程必须用到的两种主要仪器为__(填仪器名称).
(5)取25.00mL上述溶液,用0.020mol/L的酸性高锰酸钾溶液滴定,看到__,到达滴定终点,消耗高锰酸钾溶液15.50mL.则原双氧水样品中含过氧化氢__ g/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一包铝热剂(铝粉和氧化铁的混合物),进行如下实验,①向一份铝热剂中加入800ml 2mol/L的氢氧化钠溶液,使其充分反应后,收集到的气体体积为20.16L(S.T.P.)②另一份等质量的铝热剂在高温下充分反应后,向反应后固体中加入2L 2.5mol/L的盐酸溶液,使固体完全溶解,反应后溶液PH=0(假设过程中溶液体积不变),取少量反应后溶液,滴加硫氰化钾,没有出现血红色.完成下列计算:
(1)计算该铝热剂中铝与氧化铁物质的量之比?_______________
(2)实验②产生的气体的体积是多少?(S.T.P.)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸是合成阿斯匹林的重要原料.水杨酸的学名邻羟基苯甲酸,结构简式为![]() ,请回答下列问题:
,请回答下列问题:
(1)请写出水杨酸中除苯环外具有的官能团__.
(2)请写出与水杨酸互为同分异构体,既属于酚类又属于醛类化合物的结构简式(写一种即可):__.
(3)水杨酸的另一种同分异构体的结构简式为![]() ,1mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)__;
,1mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)__;
A.1mol B.2mol C.3mol D.4mol.
(4)已知有机物CH3COOH可以表示为:![]() ,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为:
,在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为: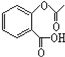 ,则阿斯匹林的分子式为__.
,则阿斯匹林的分子式为__.
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(只选一种试剂即可)__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.2,2-二甲基丁烷的1H-NMR上有4个峰
B.![]() 中所有原子处于同一平面上
中所有原子处于同一平面上
C.一定条件下1 mol![]() 与KOH溶液反应,最多消耗3 mol的KOH
与KOH溶液反应,最多消耗3 mol的KOH
D.甲苯能使酸性KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变活泼,被KMnO4氧化而断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol/L NaHA(酸式盐)溶液中分别滴加0.1mol/L 盐酸或0.1mol/L NaOH溶液,溶液的pH与滴加溶液体积关系如图所示。下列推断正确的是( )
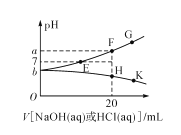
A.NaHA在水中电离程度大于水解程度
B.在对应的各点溶液中,H点水电离程度最大
C.E点对应的溶液中有c(Na+)=c(HA-)+c(A2-)
D.F点对应的溶液中存在c(H+)+c(Na+)=(OH-)+c(HA-)+c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐在工业上有重要的用途。已知其由一种阴离子,两种阳离子组成的晶体,某学习小组按如下实验测定摩尔盐样品的组成。步骤如下:
①称取3.920g摩尔盐样品配制250mL溶液。
②取少量配制溶液,加入KSCN溶液,无明显现象。
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀。
④定量测定如下:
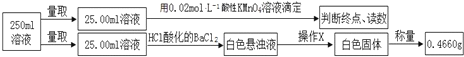
滴定实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
完成下列填空:
(1)步骤①中需要的定量仪器为________________ 、__________________。
(2)步骤②的目的是_____________________________________________________。产生红褐色沉淀的离子方程式_____________________________________。
(3)步骤④中操作X为_________________________________(按操作顺序填写)。
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,_______(填“能”或“不能”),请说明理由__________________________________________________。
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将__________。(选填“ 偏大”、“偏小”或“不变”)。
(6)通过上述实验测定结果,推断摩尔盐化学式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com