
����Ŀ����һ�����ȼ������ۺ��������Ļ�������������ʵ�飬����һ�����ȼ��м���800ml 2mol/L������������Һ��ʹ���ַ�Ӧ���ռ������������Ϊ20.16L��S��T��P��������һ�ݵ����������ȼ��ڸ����³�ַ�Ӧ����Ӧ������м���2L 2.5mol/L��������Һ��ʹ������ȫ�ܽ⣬��Ӧ����ҺPH=0�������������Һ������䣩��ȡ������Ӧ����Һ���μ����軯�أ�û�г���Ѫ��ɫ��������м��㣺
��1����������ȼ����������������ʵ���֮�ȣ�_______________
��2��ʵ��ڲ��������������Ƕ��٣���S��T��P����______________
���𰸡�2��1 13.44L
��������
��1������������������Һ��Ӧ����n(H2)��![]() ��0.9mol��������������������֮��Ĺ�ϵʽ֪������0.9mol������Ҫn(NaOH)��0.6mol��2.0mol/L��0.8L��1.6mol��˵������ȫ��Ӧ���������������Ĺ�ϵʽ�����������ʵ��������ݵ���غ����n(Fe 2+)���������������ʵ�����
��0.9mol��������������������֮��Ĺ�ϵʽ֪������0.9mol������Ҫn(NaOH)��0.6mol��2.0mol/L��0.8L��1.6mol��˵������ȫ��Ӧ���������������Ĺ�ϵʽ�����������ʵ��������ݵ���غ����n(Fe 2+)���������������ʵ�����
��2�������ݵ���غ����n(Fe 2+)����������������֮��Ĺ�ϵʽ���㷢�����ȷ�Ӧ������еĵ��ʣ��ٽ�ϵ��ʵ����ʵ��������������������
��1������������������Һ��Ӧ����n(H2)��![]() ��0.9mol��������������������֮��Ĺ�ϵʽ֪������0.9mol������Ҫn��NaOH����0.6mol��2.0mol/L��0.8L��1.6mol��˵������ȫ��Ӧ������������Ϊx��
��0.9mol��������������������֮��Ĺ�ϵʽ֪������0.9mol������Ҫn��NaOH����0.6mol��2.0mol/L��0.8L��1.6mol��˵������ȫ��Ӧ������������Ϊx��
2Al+2NaOH+2H2O��2NaAlO2+3H2��
54g 3mol
x 0.9mol
54g��3mol��x��0.9mol
x��![]() ��16.2g
��16.2g
n(Al)��![]() ��0.6mol��
��0.6mol��
�������ȼ����������ʵ���Ϊ0.6mol��
���ݵ���غ��n(H+)+2n(Fe2+)+3n(Al3+)��n(Cl��)��
1mol��2L+2��n(Fe2+)+3��0.6mol��2.5mol/L��2L
n(Fe2+)��![]() ��0.6mol��
��0.6mol��
������ԭ���غ��n(Fe2O3)��![]() n(Fe2+)��0.3mol���������������ʵ���Ϊ0.3mol
n(Fe2+)��0.3mol���������������ʵ���Ϊ0.3mol
�������ߵ����ʵ���֮��Ϊ0.6mol��0.3mol��2��1���ʴ�Ϊ��2��1��
��2����2Al+Fe2O3![]() Al2O3+2Fe���������ȷ�Ӧ����ʽ֪��0.3mol��������ȫ��Ӧ��Ҫn��Al����0.6mol����������ǡ����ȫ��Ӧ��������ԭ���غ��n(Fe)��n(Fe2+)��0.6mol������ת�Ƶ����غ���������������0.6mol��22.4L/mol��13.44L���ʴ�Ϊ��13.44L��
Al2O3+2Fe���������ȷ�Ӧ����ʽ֪��0.3mol��������ȫ��Ӧ��Ҫn��Al����0.6mol����������ǡ����ȫ��Ӧ��������ԭ���غ��n(Fe)��n(Fe2+)��0.6mol������ת�Ƶ����غ���������������0.6mol��22.4L/mol��13.44L���ʴ�Ϊ��13.44L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���úϳ�EPR��![]() �����ֵ���A��B�ϳ�PC����
�����ֵ���A��B�ϳ�PC����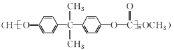 ��ϳ�·�����£�
��ϳ�·�����£�
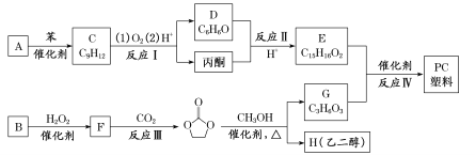
��֪����RCOOR1+R2OH![]() RCOOR2+R1OH
RCOOR2+R1OH
��(CH3)2C=CHCH3+H2O2![]()
 +H2O
+H2O
��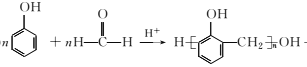 +(n-1)H2O
+(n-1)H2O
�ش��������⣺
(I)F�Ľṹ��ʽΪ__________����Ӧ��ķ�Ӧ����Ϊ___________��
(2)C������Ϊ__________��
(3)д����Ӧ���Ļ�ѧ����ʽ��____________________��
(4)������ѡ����ѡ��______�Լ�������һ���Լ���D��G��H�������ʡ�������ĸ��
A.�Ȼ�����Һ B.Ũ��ˮ C.����KMnO4��Һ
(5)���������������л���E��ͬ���칹����__________�֡�
����E����ͬ������ʣ��ں˴Ź���������6��壬�������Ϊ1��1��1��1��1��3��
(6)�Ա�ϩ�ͱ�ͪΪԭ�Ϻϳ�![]() �����Լ���ѡ��д���ϳ�·��__________________________���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
�����Լ���ѡ��д���ϳ�·��__________________________���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B������ͬ�����ʣ�����H��N��O��Na�е���������Ԫ����ɵ�ǿ����ʣ� A��ˮ��Һ�ʼ��ԣ�B��ˮ��Һ�����ԣ����ҳ�A��B���ܵ�������ϡ�Ҫ����ͬŨ��ʱ��A1��Һ��ˮ�ĵ���̶�С��A2��Һ��ˮ�ĵ���̶ȣ���ͬŨ��ʱ��B1��Һ��ˮ�ĵ���̶�С��B2��Һ��ˮ�ĵ���̶ȡ���˵����NH4NO2���ȶ��������ǣ�������д���пհף�
��1��д����ѧʽ��A1___________��A2__________��B1___________��B2___________��
��2����֪��Ka(HNO2)=4.60��10-4����0.01molL-1 HNO2��0.01molL-1 A2�������������Һ������Ũ���ɴ�С��˳��Ϊ_______________��
��3��B1��Һ��ˮ�ĵ���̶�С��B2��Һ��ˮ�ĵ���̶ȣ�ԭ����_________________��
��4�������£���B1��B2������Һ��pH��5��������Һ����ˮ������������ӵ�����
����Ũ��֮��Ϊ________��
��5�������£�0.01molL-1��HCOONa��Һ��pH=10����HCOOH�ĵ���ƽ�ⳣ��Ka=_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��л������������ȷ���ǣ�������
A.CH3��CH�TCH��CH3 ����ϩ
B.CH3OOCC2H5 ��������
C.![]() 2������3������
2������3������
D.![]() ���ȼױ�
���ȼױ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ������飨C2H5Br����װ�úͲ������£�����֪������ķе�38.4�棩�ټ��װ�õ������ԣ���װ��ͼ��ʾ�ġ��ιܺʹ��ձ��м����ˮ������Բ����ƿ�м���10mL95%�Ҵ���28mL78%Ũ���ᣬȻ�������ϸ��13g�廯�ƺͼ������Ƭ����С�ļ��ȣ�ʹ���ַ�Ӧ���ش��������⣺

��1����ʵ����ȡ������Ļ�ѧ����ʽΪ��__��
��2����Ӧʱ���¶ȹ��ߣ��ɿ����к���ɫ������������������ʽΪ__��ͬʱ���ɵ���ɫ�������ʽΪ__��
��3��Ϊ�˸��õĿ��Ʒ�Ӧ�¶ȣ�����ͼʾ��С����ȣ����õļ��ȷ�ʽ��__��
��4��U���ڿɹ۲쵽��������__��
��5����Ӧ�������ι��д��Ƶ�C2H5Br���ػ�ɫ��Ϊ�˳�ȥ�ֲ�Ʒ�е����ʣ���ѡ�������Լ��е�__������ţ���
��a��NaOH��Һ����b��H2O����c��Na2SO3��Һ ��d��CCl4
�������Ҫ����������__�����������ƣ���Ҫ��һ���Ƶô�����C2H5Br������ˮϴ��Ȼ�������ˮCaCl2���ٽ���__����������ƣ���
��6�����м���ʵ�鲽�裬�����ڼ�������������Ԫ�أ�����ȷ�IJ���˳���ǣ�ȡ���������飬Ȼ��__������ţ���
�ټ��ȣ��ڼ���AgNO3��Һ���ۼ���ϡHNO3�ữ���ܼ���NaOH��Һ������ȴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���밴Ҫ��ش��������⣺
(1)ij��̬�л���������������ܶ�Ϊ14������ṹ��ʽΪ____________��
(2)ij�л���Ľṹ��ʽ��ͼ��ʾ������һ�ȴ��ﹲ��_______�֡�
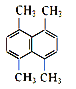
(3)��������ϵͳ����������ӦΪ_______��
(4)�ֱ����ʵ�����C3H8��C4H8��ȫȼ�գ������������������______(�����ʽ)��
(5)�������ʽ�У�ֻ�ܴ���һ���л������________(ѡ���Ӧ�����)��
��CH3 ��CH2 ��CH2O ��CH4O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A.124 g P4�����ӽṹ�� ![]() ���еĹ��ۼ���ĿΪ6NA
���еĹ��ۼ���ĿΪ6NA
B.11g����ˮ��T2O�����еĵ���������������NA
C.��״���£�22.4 L CHCl3�е�C��Cl������Ŀ����0.3NA
D.��״���£�11.2 L Cl2����ˮ�ʻ���ɫ����Һ��Cl����ClO����HClO������֮��ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������״����л��ϳ��м��塣ʵ�����ø�ʽ�Լ���![]() �������ͪ��Ӧ�Ʊ������״���
�������ͪ��Ӧ�Ʊ������״���
��֪���ٸ�ʽ�Լ��dz����ã�����ˮ��Ӧ
ʵ��������£�
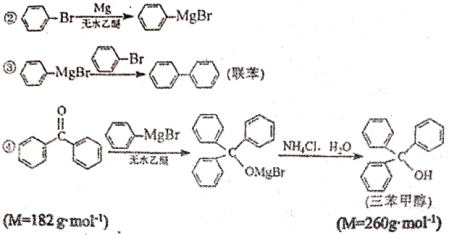
�ٺϳɸ����Լ���ʵ��װ����ͼ1��ʾ����������ƿ����0.75gþм��1С���⣬װ��װ�ã��ں�ѹ©���м���3.20 mL�屽��0.03 mol����15.00 mL���ѻ��ȣ���ʼ��������������ƿ���������á�
���Ʊ������״���ʵ��װ����ͼ1��ʾ����5.5g����ͪ��15 mL�Ҵ��ں�ѹ©���л��ȣ�����������ƿ��40������ˮԡ����0.5h������20mL�����Ȼ����Һ��ʹ��������������ϵ�в����õ��ֲ�Ʒ��
���ᴿ����ͼ2��ʾװ�ý����ᴿ�������ȴ����.
��1��ʵ���������ܼ�����Ԥ����_______�Լ���ȥ�ܽ������к�����ˮ���پ���_______�õ���
A Ũ���� B ������ C ���� D ����
��2��ͼ1ʵ���У�ʵ��װ�ô���ȱ�ݣ�Ӧ������������������_________װ�ã�
��3���ϳɸ����Լ������У�������Һ�μӹ��콫���¸����Լ������½�����ԭ����_______��
��4�����Ʊ������״��Ĺ����У������Ƚ�20mL�����Ȼ����Һһ��������ˮԡ������ԭ����__________��
��5���������ϵ�в���Ϊ_________�����ˡ�ϴ�ӡ�_________��
A �����ᾧ B ��ȴ�ᾧ C ���º�� D ��ֽ����
��6�����й��ڼ�ѹ���˵IJ�����˵����ȷ����________
A ��ֽ��С�ʵ����������пף����ܼ���ʪ��ֽ����ˮ��ͷ������ʹ��ֽ����©���ɰ���
B ���˹��˽�״��������Ϊ��״��������̫С������ֽ���γ�һ����ʵ�ij���
C ��ѹ������ϣ��ȹر�ˮ��ͷ����������ӳ����ú�����ƿ����Ƥ�ܣ���ֹ����
D ʵ�����Ҫע������ƿ��Һ��߶ȣ����쵽��֧�ܿ�λ��ʱ��Ӧ�Ȱε�����ƿ�ϵ���Ƥ�ܣ��ٴ�֧�ܿڵ�����Һ
E �����˵���Һ����ǿ���ԡ�ǿ������ʱ�����ò�����ά������ֽ���ò���ɰ©�����沼��©��
��7��ͨ���ᴿ�õ���Ʒ4.00g����ʵ�����Ϊ_________������������3λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mLNa2CO3��NaAlO2�Ļ����Һ����μ���1mol/L�����ᣬ�����Һ�е�CO32-��HCO3-��AlO2-��Al3+�����ʵ��������������Һ������仯��ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
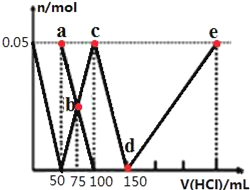
A.ԭ�����Һ�е�n��CO32-����n��AlO2-��=1��1
B.a����Һ�У�c��HCO3-��+c��H2CO3��+c��H+��=c��OH-��
C.b����Һ��Ũ��˳��Ϊ��c��Cl-����c��HCO3-����c��CO32-����c��OH-��
D.d��e�Ĺ�����ˮ�ĵ���̶���С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com