
【题目】A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质, A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。(说明:NH4NO2不稳定,不考虑),请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)已知,Ka(HNO2)=4.60×10-4,则0.01molL-1 HNO2和0.01molL-1 A2等体积混合组成溶液中离子浓度由大到小的顺序为_______________。
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是_________________。
(4)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质
的量浓度之比为________。
(5)常温下,0.01molL-1的HCOONa溶液的pH=10,则HCOOH的电离平衡常数Ka=_____。
【答案】NaOH NaNO2 HNO3 NH4NO3 c(NO2-)>c(Na+)>c(H+)>c(OH-) 硝酸电离出的氢离子抑制了水的电离,NH4+的存在促进了水的电离 1×10-4∶1 或(1∶![]() ) 10-8
) 10-8
【解析】
根据给出的元素,其中三种元素组成的强电解质,中学常见物质有:强碱(NaOH)、强酸(HNO3)、盐(NaNO3、NaNO2、NH4NO3、NH4NO2等),A的水溶液呈碱性,B的水溶液呈酸性,相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度,说明A1为强碱,A2为强碱弱酸盐,即A1为NaOH,A2为NaNO2;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度,说明B1为酸,B2强酸弱碱盐,即B1为HNO3,B2为NH4NO3,据此分析。
(1) 根据给出的元素,其中三种元素组成的强电解质,中学常见物质有:强碱(NaOH)、强酸(HNO3)、盐(NaNO3、NaNO2、NH4NO3、NH4NO2等),A的水溶液呈碱性,B的水溶液呈酸性,相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度,说明A1为强碱,A2为强碱弱酸盐,即A1为NaOH,A2为NaNO2;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度,说明B1为酸,B2强酸弱碱盐,即B1为HNO3,B2为NH4NO3;
(2)A2为NaNO2,等体积等浓度混合后,NO2-水解平衡常数为Kh=![]() =
=![]() ×10-10<10-4,说明HNO2电离大于NO2-的水解,溶液显酸性,离子浓度大小顺序是c(NO2-)>c(Na+)>c(H+)>c(OH-);
×10-10<10-4,说明HNO2电离大于NO2-的水解,溶液显酸性,离子浓度大小顺序是c(NO2-)>c(Na+)>c(H+)>c(OH-);
(3)B1为HNO3,属于酸,抑制水的电离,B2为NH4NO3,属于强酸弱碱盐,NH4+水解,促进水的电离;
(4)硝酸为酸,pH=5的硝酸溶液中c(H+)=10-5mol·L-1,该H+可以认为是由HNO3电离产生,根据水电离出c(H+)等于水电离c(OH-),因此pH=5的硝酸溶液中水电离出的c(H+)=c(OH-)=![]() mol·L-1=10-9mol·L-1,硝酸铵溶液中H+是由水电离产生,该溶液中c(H+)=10-5mol·L-1,即两溶液中水电离出c(H+)1×10-9:(1×10-5)=1×10-4:1或(1:104);
mol·L-1=10-9mol·L-1,硝酸铵溶液中H+是由水电离产生,该溶液中c(H+)=10-5mol·L-1,即两溶液中水电离出c(H+)1×10-9:(1×10-5)=1×10-4:1或(1:104);
(5)HCOONa溶液中存在HCOO-+H2O![]() HCOOH+OH-,c(CHCOOH)≈c(OH-)=
HCOOH+OH-,c(CHCOOH)≈c(OH-)=![]() =10-4mol·L-1,c(CHCOO-) ≈0.01mol·L-1,HCOO-水解常数Kh=
=10-4mol·L-1,c(CHCOO-) ≈0.01mol·L-1,HCOO-水解常数Kh=![]() =10-6,则HCOOH的电离平衡常数Ka
=10-6,则HCOOH的电离平衡常数Ka![]() =10-8。
=10-8。


科目:高中化学 来源: 题型:
【题目】![]() 的生产、应用是一个国家化工水平的重要标志。
的生产、应用是一个国家化工水平的重要标志。
(1)上海交通大学仇毅翔等研究了不同含金化合物催化乙烯加氢![]() 的反应历程如下图所示:
的反应历程如下图所示:
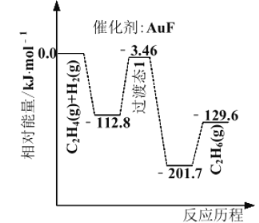
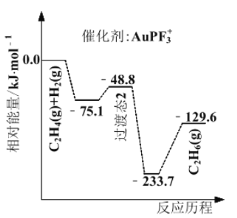
则![]() ____________,催化乙烯加氢效果较好的催化剂是________(选填“
____________,催化乙烯加氢效果较好的催化剂是________(选填“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 经催化加氢合成乙烯:
经催化加氢合成乙烯:![]() 。恒容条件下,按
。恒容条件下,按![]() 投料,各物质平衡浓度变化与温度的关系如图所示:
投料,各物质平衡浓度变化与温度的关系如图所示:
①指出图中曲线![]() 分别表示_______、________的浓度。
分别表示_______、________的浓度。
②升高温度,平衡常数![]() _________(“减小”“增大”或“不变”)。
_________(“减小”“增大”或“不变”)。![]() 点,
点,![]() ______(用
______(用![]() 表示)。写出能提高乙烯平衡产率的措施__________(任举两种)。
表示)。写出能提高乙烯平衡产率的措施__________(任举两种)。

(3)加州理工学院Theodor Agape等在强碱环境下,实现了电催化![]() 制
制![]() ,产物的选择性高达
,产物的选择性高达![]() ,
,![]() 转化为
转化为![]() 的电极反应式为___________________。
的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl﹣、SO42﹣)中回收氧化铁流程如图:

已知:常温下Ksp[Mg(OH)2]=1.2×10﹣11; Ksp[Fe(OH)2]=2.2×10﹣16;Ksp[Fe(OH)3]=3.5×10﹣38;Ksp[Al(OH)3]=1.0×10﹣33。
(1)写出在该酸性废液中通入空气时发生的离子反应方程式_____。
(2)常温下,根据已知条件在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=_____。
(3)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用_____试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A. 盐酸溶液的导电能力一定比醋酸溶液的强
B. 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的pH< 7
C. 向10 mL 0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
D. 用已知浓度的NaOH溶液滴定未知浓度的醋酸溶液,最好选用甲基橙作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下AgCl(s)的溶度积常数Ksp=1×10-10。在该温度下,向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的盐酸,生成沉淀(混合后溶液的体积变化忽略不计)。下列说法正确的是()
A.AgCl的溶解性为难溶,则该物质不溶于水
B.沉淀生成后,溶液中Ag+的浓度1×10-5mol/L
C.沉淀生成后,溶液中NO3-的浓度1.8×10-2mol/L
D.沉淀生成后,溶液的pH为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
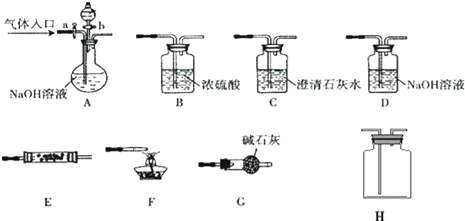
(1)实验前,如何检查A装置的气密:__。
(2)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为__(填代号)。能验证CO氧化产物的现象是__。
(3)若A中气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,H为空瓶,D中改为石蕊试液,按A→G→E→H→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①实验中先用酒精灯加热催化管,再通入混合气体,可观察到H内有红棕色气体出现,D中石蕊试液变红,则E中发生反应的方程式为__。
②若把酒精灯撤去,继续通入气体,催化剂可继续保持红热状态,反应继续进行.能使催化剂继续保持红热的原因是:__。
③某同学在做上述实验时出现了与其他同学不同的现象,他发现催化剂红热现象明显而正常,但石蕊试液不变红.请分析可能的原因:(答1点即可)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,发生反应如下:X(g) + 2Y(g)![]() W(g) + Z(g),下列物理量不能用于表明反应是否已达到平衡状态的是
W(g) + Z(g),下列物理量不能用于表明反应是否已达到平衡状态的是
A.Y的物质的量浓度
B.混合气体的密度
C.混合气体的压强
D.混合气体的平均相对分子量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一包铝热剂(铝粉和氧化铁的混合物),进行如下实验,①向一份铝热剂中加入800ml 2mol/L的氢氧化钠溶液,使其充分反应后,收集到的气体体积为20.16L(S.T.P.)②另一份等质量的铝热剂在高温下充分反应后,向反应后固体中加入2L 2.5mol/L的盐酸溶液,使固体完全溶解,反应后溶液PH=0(假设过程中溶液体积不变),取少量反应后溶液,滴加硫氰化钾,没有出现血红色.完成下列计算:
(1)计算该铝热剂中铝与氧化铁物质的量之比?_______________
(2)实验②产生的气体的体积是多少?(S.T.P.)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭体系中发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:

(1)处于平衡状态的时间段是__.
(2)t1、t3、t4时刻体系中分别改变的是什么条件?
t1:__,t3:__,t4:__.
(3)下列各时间段时,氨的体积分数最高的是______。
A.t2~t3 B.t3~t4 C.t4~t5 D.t5~t6.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com