
【题目】向100mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol/L的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。下列说法正确的是( )
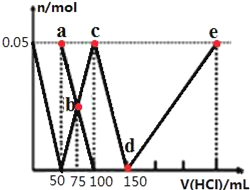
A.原混合溶液中的n(CO32-):n(AlO2-)=1:1
B.a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
C.b点溶液中浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)
D.d→e的过程中水的电离程度逐渐减小
【答案】AC
【解析】
Na2CO3、NaAlO2的混合溶液中逐滴加入1molL﹣1的盐酸:
首先,发生反应AlO2﹣+H++H2O═Al(OH)3↓,最左边曲线表示AlO2﹣,由图可知AlO2﹣反应完毕,加入盐酸50mL,根据方程式可知n(AlO2﹣)=n(H+)=0.05L×1mol/L=0.05mol;
第二阶段,AlO2﹣反应完毕,发生反应CO32﹣+H+═HCO3﹣,ab线表示CO32﹣,bc线表示HCO3﹣,由图可知CO32﹣反应完毕,该阶段加入盐酸100mL﹣50mL=50mL,根据方程式可知n(CO32﹣)=n(H+)=0.05L×1mol/L=0.05mol;
第三阶段,CO32﹣反应完毕,发生反应HCO3﹣+H+═CO2↑+H2O,cd线表示HCO3﹣,由图可知HCO3﹣反应完毕,该阶段加入盐酸150mL﹣100mL=50mL,根据方程式可知n(HCO3﹣)=n(H+);
第四阶段,发生反应Al(OH)3+3H+═Al3++3H2O,de线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为![]() =0.15L=150mL;
=0.15L=150mL;
A.由上述分析可知,原混合溶液中的CO32﹣与AlO﹣2的物质的量之比为0.05mol:0.05mol=1:1,故A正确;
B.a点溶液中,溶质为Na2CO3,由质子守恒可知:c(HCO3﹣)+2c(H2CO3)+c(H+)=c(OH﹣),故B错误;
C.b点碳酸钠和碳酸氢钠的浓度相等,加入了75mL盐酸,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3﹣)>c(CO32﹣),所得溶液中阴离子浓度大小顺序为:c(Cl﹣)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣),故C正确;
D.d→e的过程中铝离子的浓度逐渐增大,铝离子水解促进了水的电离,则该段水的电离程度逐渐增大,故D错误;
故答案为AC。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将一包铝热剂(铝粉和氧化铁的混合物),进行如下实验,①向一份铝热剂中加入800ml 2mol/L的氢氧化钠溶液,使其充分反应后,收集到的气体体积为20.16L(S.T.P.)②另一份等质量的铝热剂在高温下充分反应后,向反应后固体中加入2L 2.5mol/L的盐酸溶液,使固体完全溶解,反应后溶液PH=0(假设过程中溶液体积不变),取少量反应后溶液,滴加硫氰化钾,没有出现血红色.完成下列计算:
(1)计算该铝热剂中铝与氧化铁物质的量之比?_______________
(2)实验②产生的气体的体积是多少?(S.T.P.)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭体系中发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
2NH3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:

(1)处于平衡状态的时间段是__.
(2)t1、t3、t4时刻体系中分别改变的是什么条件?
t1:__,t3:__,t4:__.
(3)下列各时间段时,氨的体积分数最高的是______。
A.t2~t3 B.t3~t4 C.t4~t5 D.t5~t6.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应2HI(g) ![]() H2(g) + I2(g) - 11 kJ,正确的是
H2(g) + I2(g) - 11 kJ,正确的是
A.反应物的总键能低于生成物的总键能
B.1mol I2(g)中通入1mol H2(g),反应放热11kJ
C.等物质的量时,I2(g)具有的能量低于I2(l)
D.平衡时分离出HI(g),正反应速率先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐在工业上有重要的用途。已知其由一种阴离子,两种阳离子组成的晶体,某学习小组按如下实验测定摩尔盐样品的组成。步骤如下:
①称取3.920g摩尔盐样品配制250mL溶液。
②取少量配制溶液,加入KSCN溶液,无明显现象。
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀。
④定量测定如下:
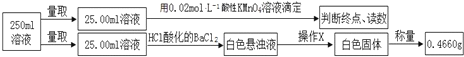
滴定实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
完成下列填空:
(1)步骤①中需要的定量仪器为________________ 、__________________。
(2)步骤②的目的是_____________________________________________________。产生红褐色沉淀的离子方程式_____________________________________。
(3)步骤④中操作X为_________________________________(按操作顺序填写)。
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,_______(填“能”或“不能”),请说明理由__________________________________________________。
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将__________。(选填“ 偏大”、“偏小”或“不变”)。
(6)通过上述实验测定结果,推断摩尔盐化学式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
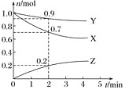
A.X+3Y![]() 2Z 0.1 mol L-1min-1B.2X+Y
2Z 0.1 mol L-1min-1B.2X+Y![]() 2Z 0.1 mol L-1min-1
2Z 0.1 mol L-1min-1
C.X+2Y![]() Z 0.05 mol L-1min-1D.3X+Y
Z 0.05 mol L-1min-1D.3X+Y![]() 2Z 0.05 mol L-1min-1
2Z 0.05 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况).则原混合物中Na2O2和NaHCO3的物质的量之比为
A.8:1B.2:1C.3:2D.2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用测量压强的仪器测定生铁在90%醋酸溶液中发生腐蚀的装置及容器内压强随时间变化如图所示,下列分析错误的是

A.0~t1,可能发生了析氢腐蚀压强增大
B.0~t1,可能反应放热温度升高压强增大
C.t2时压强小于起始压强,一定发生了吸氧腐蚀
D.整个过程中铁粉发生了还原反应生成Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com