
【题目】摩尔盐在工业上有重要的用途。已知其由一种阴离子,两种阳离子组成的晶体,某学习小组按如下实验测定摩尔盐样品的组成。步骤如下:
①称取3.920g摩尔盐样品配制250mL溶液。
②取少量配制溶液,加入KSCN溶液,无明显现象。
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀。
④定量测定如下:
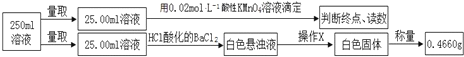
滴定实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
完成下列填空:
(1)步骤①中需要的定量仪器为________________ 、__________________。
(2)步骤②的目的是_____________________________________________________。产生红褐色沉淀的离子方程式_____________________________________。
(3)步骤④中操作X为_________________________________(按操作顺序填写)。
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,_______(填“能”或“不能”),请说明理由__________________________________________________。
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将__________。(选填“ 偏大”、“偏小”或“不变”)。
(6)通过上述实验测定结果,推断摩尔盐化学式为______________________________。
【答案】电子天平 250mL容量瓶 确定红褐色沉淀中的铁元素在摩尔盐中是以亚铁离子形式存在 4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓ 过滤、洗涤、干燥或烘干(冷却) 不能 碘单质与亚铁离子不反应 偏小 (NH4)2SO4FeSO46H2O或(NH4)2Fe(SO4)26H2O
【解析】
(1)配制摩尔盐溶液时,称取3.9200g摩尔盐样品要用电子天平称取,根据装置图可知,配制250mL溶液定容时要用250mL容量瓶;
(2)②取少量配制溶液,加入KSCN溶液,无明显现象,证明无铁离子存在,确定红褐色沉淀中的铁元素在摩尔盐中是以亚铁离子形式存在,产生红褐色沉淀的离子方程式为:4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓;
(3)根据实验二③中操作流程可知,白色悬浊液为硫酸钡,要精确称量硫酸钡的质量要经过过滤、洗涤、干燥再称量;
(4)步骤④中酸性高锰酸钾溶液不能用碘的酒精溶液代替,因为碘单质和亚铁离子不发生反应,不能测定实验;
(5)步骤④若在滴定过程中,待测液久置,空气中氧气氧化亚铁离子,消耗标准溶液高锰酸钾溶液体积减小,c(待测)=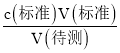 可知测定亚铁离子减小,故答案为偏小;
可知测定亚铁离子减小,故答案为偏小;
(6)根据题中实验步骤及数据可知,滴定亚铁离子用去的高锰酸钾溶液的体积的数据中,第一次误差较大,为偶然误差应去掉,所以高锰酸钾溶液的体积为![]() mL=10.00mL,高锰酸钾的物质的量为0.02mol/L×0.01L=0.0002mol,根据反应MnO4﹣+5Fe2++8H+=Mn2++5Fe3++4H2O,可知3.9200g摩尔盐样品中亚铁离子的物质的量为0.0002mol×
mL=10.00mL,高锰酸钾的物质的量为0.02mol/L×0.01L=0.0002mol,根据反应MnO4﹣+5Fe2++8H+=Mn2++5Fe3++4H2O,可知3.9200g摩尔盐样品中亚铁离子的物质的量为0.0002mol×![]() ×5=0.01mol,其质量为0.5600g,白色固体硫酸钡为0.4660g,所以3.9200g摩尔盐样品中硫酸根离子的物质的量为
×5=0.01mol,其质量为0.5600g,白色固体硫酸钡为0.4660g,所以3.9200g摩尔盐样品中硫酸根离子的物质的量为![]() ×
×![]() =0.02mol,其质量为1.9200g,根据电荷守恒可知3.9200g摩尔盐样品中铵根离子的物质的量为0.02mol×2﹣0.01mol×2=0.02mol,其质量为0.3600g,所以样品中结晶水物质的量为
=0.02mol,其质量为1.9200g,根据电荷守恒可知3.9200g摩尔盐样品中铵根离子的物质的量为0.02mol×2﹣0.01mol×2=0.02mol,其质量为0.3600g,所以样品中结晶水物质的量为![]() =0.06mol,所以摩尔盐的组成为(NH4)2SO4FeSO46H2O或(NH4)2Fe(SO4)26H2O。
=0.06mol,所以摩尔盐的组成为(NH4)2SO4FeSO46H2O或(NH4)2Fe(SO4)26H2O。


科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)某气态有机物相对于氢气的密度为14,则其结构简式为____________。
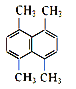
(2)某有机物的结构简式如图所示,则其一氯代物共有_______种。
(3)新戊烷用系统命名法命名应为_______。
(4)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是______(填分子式)。
(5)下列最简式中,只能代表一种有机物的有________(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:①2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
②C3H8(g)+5O2(g)=3CO2(g) +4H2O(g) △H=-2044.0kJ·mol-1
(1)氢气的燃烧热是__________
(2)已知:H2O(l)=H2O(g) △H=+44.0kJ·mol-1,写出丙烷(C3H8)燃烧生成二氧化碳和液态水的热化学方程式:__________
(3)实验测得H2和C3H8的混合气体共3mol,完全燃烧生成液态水时放热2791.6kJ,计算混合气体中H2和C3H8的体积比是_____
(4)恒温恒容条件下,硫可以发生如下反应,其反应过程和能量关系如图所示,已知2SO2(g)+O2(g)=2SO3(g) △H=-196.6kJ·mol-1
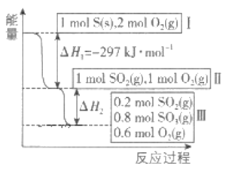
①写出能表示硫的燃烧热的热化学方程式:__________
②△H2=__________kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D存在下图转化关系(部分生成物和反应条件略去)。下列物质中符合转化关系的A的个数为A![]() B
B![]() C,①Cl2 ②S ③Fe ④NH3 ⑤AlCl3 ⑥Na2CO3
C,①Cl2 ②S ③Fe ④NH3 ⑤AlCl3 ⑥Na2CO3
A.3B.4C.5D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol/L的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。下列说法正确的是( )
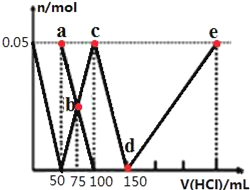
A.原混合溶液中的n(CO32-):n(AlO2-)=1:1
B.a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
C.b点溶液中浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)
D.d→e的过程中水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是

A. 水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键所致
B. 乳酸(![]() )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①难溶电解质达到沉淀溶解平衡时,溶液中各种离子的溶解(或沉淀)速率都相等
②难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动
③向Na2SO4溶液中加入过量的BaCl2溶液,则![]() 沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含
沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含![]()
④Ksp小的物质其溶解能力一定比Ksp大的物质的溶解能力小
⑤为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀
⑥洗涤沉淀时,洗涤次数越多越好
A.①②③B.①②③④⑤⑥C.⑤D.①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烯烃为原料,合成某些高聚物的路线如图:
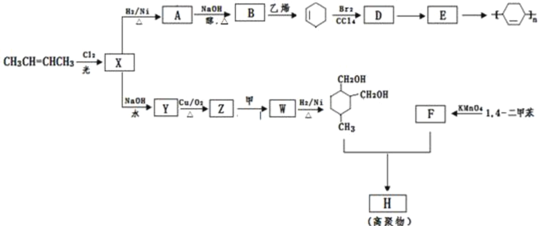
已知:Ⅰ.![]() (或写成
(或写成![]() R代表取代基或氢)
R代表取代基或氢)
Ⅱ.甲为烃
Ⅲ.F能与NaHCO3反应产生CO2请完成以下问题:
(1)CH3CH=CHCH3的名称是______,Br2的CCl4溶液呈______色.
(2)X→Y的反应类型为:______;D→E的反应类型为:______.
(3)H的结构简式是______.
(4)写出下列化学方程式:
A→B______;
Z→W______.
(5)化工生产表明高聚物H的产率不及设计预期,产率不高的原因可能是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2Na2CO3+ SnO2+4S![]() Na2SO4 + Na2SnS3+2CO2↑ ,回答下列问题:
Na2SO4 + Na2SnS3+2CO2↑ ,回答下列问题:
【1】①写出碳原子最外电子层的轨道表示式______。在上述反应的生成物中,属于分子晶体的化合物的结构式为______。
②在上述反应中非金属元素的非金属性由强到弱顺序为:______;其中的单质原子核外有______种不同能量的电子。
【2】上述反应中,金属性最强的元素与铝元素相比较,可以作为判断两者金属性强弱依据的是_________(选填编号)。
a.能否置换出硫酸铜溶液中的铜离子
b.Al(OH)3能否溶解在该元素最高价氧化物对应的水化物中
c.单质与氯气化合时失去电子数目的多少
d.单质与同浓度的稀盐酸发生反应的剧烈程度
【3】在上述反应中氧化剂与还原剂的物质的量之比是________。常温下,测得Na2SnS3溶液pH>7,请用离子方程式解释其原因:________。
【4】锡(Sn)元素的单质有两种常见的同素异形体——灰锡和白锡。已知:Sn(s、灰)![]() Sn(s、白)-2.1 kJ,根据以上信息得出的结论正确的是__________。
Sn(s、白)-2.1 kJ,根据以上信息得出的结论正确的是__________。
a.灰锡和白锡的互相转化是可逆反应
b.常温下锡主要以灰锡的状态存在
c.白锡所具有的能量高
d.同素异形体的相互转化肯定也是化学变化,但却不属于氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com