
【题目】下列有关说法正确的是![]()
A.反应![]() 室温下不能自发进行,则该反应的
室温下不能自发进行,则该反应的![]()
B.配制硫酸亚铁溶液时,需将![]() 先溶于硝酸再用蒸馏水稀释,最后加少量铁粉
先溶于硝酸再用蒸馏水稀释,最后加少量铁粉
C.![]() 溶液加蒸馏水稀释,
溶液加蒸馏水稀释,![]() 的水解程度增大,溶液的pH减小
的水解程度增大,溶液的pH减小
D.在硫酸钡悬浊液中加入足量饱和![]() 溶液处理,向所得沉淀中加入盐酸有气体产生,说明
溶液处理,向所得沉淀中加入盐酸有气体产生,说明![]()
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s)![]() Ca(OH)2(aq)
Ca(OH)2(aq)![]() Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
A. n (Ca2+)增大 B. c(Ca2+)不变
C. c(OH-)增大 D. n(OH-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应A(g)+2B(g)=3C(g)+4D(g)中,表示该反应速率最快的是
A.v(A)=0.5mol/(L·s)
B.v(B)=0.5mol/(L·s)
C.v(C)=0.8mol/(L·s)
D.v(D)=1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素含量居金属首位,主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ.工业上用铝土矿制备铝的某种化合物的工艺流程如图:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:___Fe2++___ClO-+___=___Fe(OH)3↓+___C1-+___
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、___(填操作名称)、过滤、洗涤。
Ⅱ.铵明矾(NH4Al(SO4)212H2O)是常见的食品添加剂,在日常生活、生产中也占有一席之地。
(1)铵明矾可用于净水,用离子方程式表示其净水原理___;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是___。
(2)实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=___。
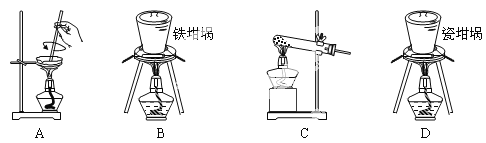
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂用闪锌矿制备锌及颜料 A(红棕色固体)的工艺流程如下图所示。(闪锌矿的主要成分为 ZnS,同时含有 10%的 FeS 及少量 CuS)
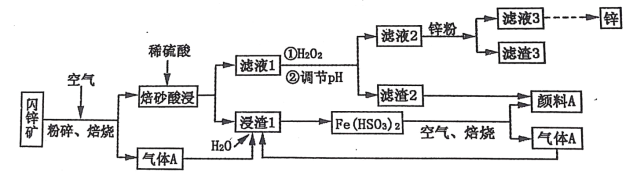
已知:①闪锌矿在焙烧时会生成副产物 ZnFeO4,ZnFeO4 不溶于水及硫酸。Fe(HSO3)2 难溶于水。②Ksp[Fe(OH)3]=1×10-39。
完成下列问题
(1)闪锌矿粉碎的目的是_______________________________________________________。
(2)“滤液 1”中选用足量的 H2O2,理由是_____________________。假设“②调节 pH"前,滤液 1 中 c(Fe3+)=1molL-1 ,则 Fe3+ 完全沉淀时的 pH 至少为____________________。(离子浓度≤ 10-6mol·L-1 规为完全除去)。
(3)“滤渣 3”的成分为__________________________________ (写化学式)。
(4)设计一种检验“颜料 A”中是否含有 Fe2+的实验方案_______________________________________________________。
(5)“气体 A”与“浸渣 1”反应的化学方程式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:

(1)该密闭容器的容积是___。
(2)达到未平衡状态的时刻是___min(填“3”或“10”)。
(3)在前3min内,用H2浓度的变化表示的反应速率v(H2)=___mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为__。
(5)达平衡后H2O(g)的物质的量分数是___。
(6)已知:①CO(g)+2H2(g)=CH3OH(g) △H=-90.1kJ/mol,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.1kJ/mol,则CO2与H2反应合成CH3OH(g)的热化学方程式__,反应在10min内所放出的热量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中两种气体的分子数一定相等的是( )
A.温度相同、体积相同的O2和N2
B.质量相等、密度不等的N2和C2H4
C.体积相同、密度不相等的CO和C2H4
D.压强相同、体积相同的O2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂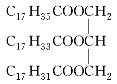 能发生的反应有( )
能发生的反应有( )
①皂化反应 ②使高锰酸钾酸性溶液褪色 ③使溴水褪色 ④氧化反应 ⑤还原反应 ⑥加成反应
A.①⑤B.①②③④
C.①④⑤⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。如图是硫元素的价类二维图,回答下列问题:

(1)图中已标明的物质中(不含X、Y),属于电解质的有______________种。
(2)X的化学式为________;标准状况下,______mol Y与3.36L SO2具有相同数目的氧原子。
(3)某同学欲选用如图的部分装置和药品探究SO2的性质。
A. 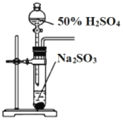 B. 溴水
B. 溴水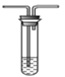 C.氢氧化钠溶液
C.氢氧化钠溶液 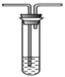 D. 石蕊溶液
D. 石蕊溶液 E. H2S溶液
E. H2S溶液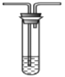
①为验证SO2具有氧化性和还原性,装置连接顺序为__________(用字母表示)。体现SO2具有还原性的反应方程式为______________。
②下列反应中,不属于SO2类别通性的是___________。
A.SO2 + H2OH2SO3
B.2SO2 + O2![]() 2SO3
2SO3
C.SO2 + 2NaOH = Na2SO3 + H2O
D.SO2 + CaO = CaSO3
(4)该同学设计如图装置进一步探究锌与浓硫酸反应除生成SO2外,是否还有氢气生成。(X为锌与浓硫酸共热时产生的气体)

①B中加入的试剂是___________;E的作用是_______。
②可以证明气体X中含有氢气的实验现象是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com