
����Ŀ���ݱ��������Ħ��������MOTOROLA����˾�з���һ���ɼ״��������Լ�ǿ�����������Һ�������ֻ���أ����������������غ�﮵�ص�10����������ʹ��1���³��һ�Ρ��ٶ��ŵ�����У��״���ȫ����������CO2�������������CO32��
��1���õ�ط�Ӧ�������ӷ���ʽΪ____________________________________________��
��2���״���______��������Ӧ��������������ڷŵ��������Һ��pH��______����ͻ����������䣩������16�˼״���������ȫ����,�����ĵ��ܵ��������CuSO4��Һ����������������������������Ϊ80������������״���µ�O2________����
��3����������п�ѧ�������һ�ֹ������ʵ�ȼ�ϵ�أ���Ч�ʸ��ߡ�һ���缫ͨ���������һ�缫ͨ���������������й��������Dz�����Y2O3��Y���ƣ���ZrO2��Zr��ﯣ����壬���ڸ������ܴ���O2�����ӣ�����������Ӧ������ȫ�����Զ��飨C4H10���������͡�
�ٵ�صĸ�����ӦʽΪ____________________________________________��
�ڷŵ�ʱ�����������O2�����ӵ��ƶ���������____________���ƶ�����������
���𰸡� 2CH3OH��3O2��4OH��==2CO32��+6H2O �� ���� 13.44 C4H10��13O2����26e�� == 4CO2 ��5H2O ��
��������������������⿼��״�ȼ�ϵ�غ���ȼ�ϵ�صĹ���ԭ�����йص绯ѧ�ļ��㡣
��1���ŵ�����м״��������ɵ�CO2��ǿ��Һ�����������CO32-����ط�Ӧ�������ӷ���ʽΪ2CH3OH��3O2��4OH��=2CO32��+6H2O��
��2���״�����ʧ���ӵ�������Ӧ���״��ڸ���������Ӧ������ڷŵ����������OH-������H2O�����Էŵ��������Һ��pH�����͡��״������ĵ缫��ӦΪCH3OH-6e��+8OH��=CO32-+6H2O�����CuSO4��Һʱ����O2�ĵ缫��ӦʽΪ4OH��-4e��=O2��+2H2O�����ݵ����غ��� ![]() 6
6![]() 80%=
80%=![]() 4�����V��O2��=13.44L��
4�����V��O2��=13.44L��
��3��������ܷ�ӦΪ2C4H10+13O2=8CO2+10H2O�����ڹ��������ڸ������ܴ���O2-����ص�������ӦʽΪO2+4e��=2O2-��������Ӧʽ�ɵ���ܷ�Ӧ��ȥ������Ӧʽ����ȥO2����������ӦʽΪ2C4H10-52e��+26O2-=8CO2+10H2O����һ������ΪC4H10-26e��+13O2-=4CO2+5H2O��
��O2-Ϊ�����ӣ�Ӧ���ƶ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ɽ����ѡ�������������ͭ�Ƚ������仯�����ڹ�ҵ������;��
��1�������Ͻ���з����¶ȵ͡��۸����е��ŵ㣬����ϵ����Ͻ�Ĵ�����
��Ti�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ___________________________��
��FeԪ�������ڱ��е�λ����___________________________��
��2���Ʊ� CrO2Cl2�ķ�ӦΪ K2Cr2O7��3CCl4 ��2KCl��2 CrO2Cl2��3COCl2����
��������ѧ����ʽ�зǽ���Ԫ�ص縺���ɴ�С��˳��______________��(��Ԫ�ط��ű�ʾ)
��COCl2����������ԭ�Ӿ�����8���ӹ�����COCl2�����������������ĸ�����Ϊ________������ԭ�ӵ��ӻ���ʽΪ_____________��
��3��NiO��FeO�ľ���ṹ����NaCl�ľ���ṹ���ƣ�����Ni2+��Fe2+�����Ӱ뾶�քeΪ6.9��10-2nm��7.8��10-2nm�����۵㣺NiO _______ FeO (���������������� �� ���� )��
��4��Ni��La�ĺϽ���Ŀǰʹ�ù㷺�Ĵ�����ϣ����д����������������͵��µ��ص㣬���й���ʵ���˲�ҵ�����úϽ�ľ����ṹ��ͼ��ʾ��

���þ���Ļ�ѧʽΪ______________��
����֪�þ�����Ħ������ΪMg/mol���ܶ�Ϊdg/cm3����NAΪ�����ӏ�������ֵ����þ����������____________ cm3 (�ú�M��d��NA�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��ϳɵĹؼ�����������ź���̼�Ǽܡ����з�Ӧ��������-OH���ǣ� ��
A.�ӳɷ�ӦB.ˮ�ⷴӦC.��ȥ��ӦD.��ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ԭ����Ŀ���ɴ�С˳�����е��ǣ� ��
��0.6mol NH3 ��0.2mol H3PO4 ��9g H2O �ܱ�״����22.4L He��
A.�٢ڢۢ�
B.�ڢۢ٢�
C.�ڢ٢ۢ�
D.�٢ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪1��3������ϩ��CH2=CH��CH=CH2������ˮ����1: 1�ӳɣ����ʵ���֮�ȣ�ʱ���ӳɲ���������2�֣�CH2=CH��CH=CH2+Br2![]() CH2BrCHBr��CH=CH2 ����Ϊ1,2���ӳɣ���CH2=CH��CH=CH2+Br2
CH2BrCHBr��CH=CH2 ����Ϊ1,2���ӳɣ���CH2=CH��CH=CH2+Br2![]() CH2BrCH=CHCH2Br ����Ϊ1,4���ӳɣ���
CH2BrCH=CHCH2Br ����Ϊ1,4���ӳɣ���
����C4H4�ж���ͬ���칹�壬���Ƿֱ����������������д����Ӧͬ���칹��Ľṹ��ʽ��
��1��AΪ��״�ṹ��������������Ȳ�ӳɵõ���A�Ľṹ��ʽΪ________________��
��2��BΪƽ��ṹ����Br2����1��1�����ʵ���֮�ȣ����ӳɷ�ʽ��2�֣����ӳɲ���ֻ��1�֣�B�Ľṹ��ʽΪ___________________________________________��
��3��CΪ��������ṹ��ÿ��̼ԭ��������3��̼ͨ������������C�ĵĽṹ��ʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ͭпԭ���װ�á����ص��ܷ�Ӧ�ǣ�Zn(s)+CuSO4(aq)��ZnSO4(aq)+Cu(s)����ش��������⣺
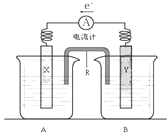
��1��R��������___________��R�е�����������_______����A��B���е���Һ
��2���缫Y�IJ�����________��B�еĵ������Һ��________________��
��3��XΪԭ��ص�______������缫��Ӧʽ��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪G��Q��X��Y��Z��Ϊ����Ԫ�صĻ������һ��������������ת����ϵ(δ��ƽ)��
��G�D��Q��NaCl����Q��H2O![]() X��H2
X��H2
��Y��NaOH�D��G��Q��H2O
��Z��NaOH�D��Q��X��H2O
�����ֻ�������ClԪ�ػ��ϼ��ɵ͵��ߵ�˳����(����)
A. G��Y��Q��Z��X B. X��Z��Q��G��Y
C. X��Z��Q��Y��G D. G��Q��Y��Z��X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���ʳ��ˮ�м���a g NaCl����ֽ���һ��ʱ���������������ȷ���ǣ� ��
A. ���ʵ������������� B. �ܽ�Ȳ���
C. ��Һ���������� D. �Ȼ��ƹ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ�㷺�ش���������������֮�У�
��1��ͭ˿����AgNO3��Һ����ḽ������ɫ���ʣ���ԭ�ԣ���������ڡ�����С�ڡ����ڡ�����ͬ��ͭ��
��2��Ϊ���ε�ȱ������ͨ����ʳ�������������ĵ���أ�KIO3��������غ͵⻯������Һ���ܷ������з�Ӧ��KIO3+5KI+3H2SO4�T3I2+3K2SO4+3H2O
�ٸ÷�Ӧ�У����������뻹ԭ���������֮��Ϊ
�ڵ���1mol I2����ʱ����mol��ԭ����������
��3��ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ5�����ʣ�H2S��HNO3��NO��H2O��X��
����֪H2S�ڷ�Ӧ��ʧȥ���ӣ���÷�Ӧ���������� ��
����֪0.5mol H2S�ڷ�Ӧ��ʧȥ1mol��������X����X�Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com