
����Ŀ�����ɽ����ѡ�������������ͭ�Ƚ������仯�����ڹ�ҵ������;��
��1�������Ͻ���з����¶ȵ͡��۸����е��ŵ㣬����ϵ����Ͻ�Ĵ�����
��Ti�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ___________________________��
��FeԪ�������ڱ��е�λ����___________________________��
��2���Ʊ� CrO2Cl2�ķ�ӦΪ K2Cr2O7��3CCl4 ��2KCl��2 CrO2Cl2��3COCl2����
��������ѧ����ʽ�зǽ���Ԫ�ص縺���ɴ�С��˳��______________��(��Ԫ�ط��ű�ʾ)
��COCl2����������ԭ�Ӿ�����8���ӹ�����COCl2�����������������ĸ�����Ϊ________������ԭ�ӵ��ӻ���ʽΪ_____________��
��3��NiO��FeO�ľ���ṹ����NaCl�ľ���ṹ���ƣ�����Ni2+��Fe2+�����Ӱ뾶�քeΪ6.9��10-2nm��7.8��10-2nm�����۵㣺NiO _______ FeO (���������������� �� ���� )��
��4��Ni��La�ĺϽ���Ŀǰʹ�ù㷺�Ĵ�����ϣ����д����������������͵��µ��ص㣬���й���ʵ���˲�ҵ�����úϽ�ľ����ṹ��ͼ��ʾ��

���þ���Ļ�ѧʽΪ______________��
����֪�þ�����Ħ������ΪMg/mol���ܶ�Ϊdg/cm3����NAΪ�����ӏ�������ֵ����þ����������____________ cm3 (�ú�M��d��NA�Ĵ���ʽ��ʾ����
���𰸡� 3d24s2 �������ڵ����� O��Cl��C 3��1 sp2�ӻ� �� LaNi5 ![]()
����������1����Ԫ��Ϊ24��Ԫ�أ���۵����Ų�ʽΪ��3d24s2����FeԪ��Ϊ26�ţ������������Ų�ʽ��֪�������ڱ��е�λ���ǵ������ڵڢ��塣
��2����K2Cr2O7��3CCl4 ��2KCl��2 CrO2Cl2��3COCl2���зǽ���Ԫ��ΪO��Cl��C�������������ڱ��е�λ�ÿ�֪�縺�Դ�С���ɴ�С��˳��ΪO��Cl��C�����ɼ۲���ӶԻ�������n=(4+2)/2=3��������ԭ��̼ԭ�Ӳ�ȡsp2�ӻ���̼����Ϊ˫����̼�ȼ�Ϊ��������COCl2�����������������ĸ�����Ϊ3��1��
��3��NiO��FeO�ľ���ṹ���ƣ�����Ni2+���Ӱ뾶С��Fe2+�����Ӱ뾶�����۵㣺NiO����FeO��
��4����La�������㣬ƽ̯��1����Ni��������1�������µ���ƽ̯4/2=2��������4��ƽ̯��2������5������ѧʽΪLaNi5�������ܶȡ�Ħ��������������NA��ϵ��ʽ��d=ZM/NA/V����˾�����ֻ����һ��LaNi5��Z=1���ʿɵøþ����������![]() cm3 ��
cm3 ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������泥�NH2COONH4������Ҫ�İ��������ڳ�ʪ�Ŀ�������ת��Ϊ̼��泥������ֽ⡢�ױ�������ʵ��С���������淋����ʽ���������̽������ش��������⣺
��1������������ڳ�ʪ�Ŀ�����ת��Ϊ̼��淋Ļ�ѧ����ʽΪ____________________________��
��2������ͼװ��̽����������淋ķֽ����г�װ����ȥ����ͬ����

�ٵ�ȼA���ľƾ���֮ǰ�����ȴ�k����װ����ͨ��һ��ʱ���N2��Ŀ��Ϊ_________________��
������B������Ϊ_________________��
��װ��D������Ϊ________________________________________________________��
����֤���ֽ��������NH3������Ϊ_________________________________________��
���Լ�A���ڼ���ֽ�����е�CO2�����Լ�������Ϊ_______________________��
��3����֪��CuO�����ֽܷ�ΪCu2O��O2����������װ�ú����в���װ�ý�һ������ֽ�������Ƿ���CO��װ��E��Ӧ��������_________________���������ҵ�����˳����ѡ����ĸ����
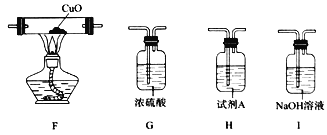
��4��ͨ��ʵ��ó����ۣ�������������ȷֽ�ΪNH3��CO2���÷�Ӧ�Ļ�ѧ����ʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������SO2�������У���ȷ����
A. 1 mol SO2��������64 g/mol
B. ���³�ѹ�£�1 mol SO2�����Ϊ22.4 L
C. SO2��Ħ��������64 g
D. 1mol SO2������������ԼΪ6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ�����ɽ�һ�����ʹ���������������������:

(1)����±��������____________________ (�����,��ͬ)��
(2)����ϩ������______________________
(3)����ͬ���칹�����___________________________
(4)���ڷ���������______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У��������뻹ԭ����ѧ������Ϊ1��2���ǣ� ��
A.Fe+2HCl�TFeCl2+H2��
B.2HCl+Ca��ClO��2�T2HClO+CaCl2
C.I2+2NaClO3�T2NaIO3+Cl2��
D.4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӹ���Ϊ[Ar]3d54s2��Ԫ������������һ��Ԫ�أ� ��
A. ϡ������ B. ����Ԫ�� C. ����Ԫ�� D. ±��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ�� 2 A(g) + B(g) ![]() 3 C(g) + D(g)���Ը�����ͼ�ж���ȷ����
3 C(g) + D(g)���Ը�����ͼ�ж���ȷ����

A. �¶�T1�� �� T2����
B. ����ӦΪ���ȷ�Ӧ
C. ��ͼ������Ա�ʾA��ת����
D. ��ͼ������Ա�ʾ�������ƽ����Է�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£��������ʵ����������
A. 0.5 mol CO2 B. 100g ���ܶ�Ϊ1.84g/cm3����������Ϊ98%��Ũ����
C. 112g Fe D. 3 mol H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ��������Ħ��������MOTOROLA����˾�з���һ���ɼ״��������Լ�ǿ�����������Һ�������ֻ���أ����������������غ�﮵�ص�10����������ʹ��1���³��һ�Ρ��ٶ��ŵ�����У��״���ȫ����������CO2�������������CO32��
��1���õ�ط�Ӧ�������ӷ���ʽΪ____________________________________________��
��2���״���______��������Ӧ��������������ڷŵ��������Һ��pH��______����ͻ����������䣩������16�˼״���������ȫ����,�����ĵ��ܵ��������CuSO4��Һ����������������������������Ϊ80������������״���µ�O2________����
��3����������п�ѧ�������һ�ֹ������ʵ�ȼ�ϵ�أ���Ч�ʸ��ߡ�һ���缫ͨ���������һ�缫ͨ���������������й��������Dz�����Y2O3��Y���ƣ���ZrO2��Zr��ﯣ����壬���ڸ������ܴ���O2�����ӣ�����������Ӧ������ȫ�����Զ��飨C4H10���������͡�
�ٵ�صĸ�����ӦʽΪ____________________________________________��
�ڷŵ�ʱ�����������O2�����ӵ��ƶ���������____________���ƶ�����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com