
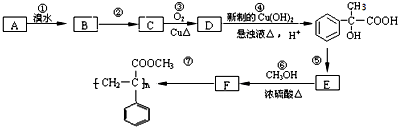
 ,则C为
,则C为 ,故A为
,故A为 ,A与溴发生加成反应生成B为
,A与溴发生加成反应生成B为 ,B在氢氧化钠水溶、加热条件下发生水解反应生成C.由F发生加聚反应的产物可知,F为
,B在氢氧化钠水溶、加热条件下发生水解反应生成C.由F发生加聚反应的产物可知,F为 ,则E与甲醇发生酯化反应生成F,故E为
,则E与甲醇发生酯化反应生成F,故E为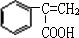 ,反应⑤是在氢氧化钠醇溶液、加热条件下发生消去反应生成E,据此解答.
,反应⑤是在氢氧化钠醇溶液、加热条件下发生消去反应生成E,据此解答. ,则C为
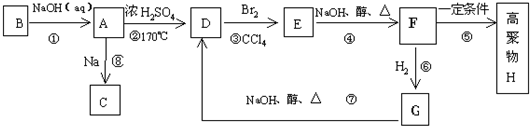
,则C为 ,故A为
,故A为 ,A与溴发生加成反应生成B为
,A与溴发生加成反应生成B为 ,B在氢氧化钠水溶、加热条件下发生水解反应生成C.由F发生加聚反应的产物可知,F为
,B在氢氧化钠水溶、加热条件下发生水解反应生成C.由F发生加聚反应的产物可知,F为 ,则E与甲醇发生酯化反应生成F,故E为
,则E与甲醇发生酯化反应生成F,故E为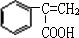 ,反应⑤是在氢氧化钠醇溶液、加热条件下发生消去反应生成E,
,反应⑤是在氢氧化钠醇溶液、加热条件下发生消去反应生成E, ,F结构简式为
,F结构简式为 ,故答案为:
,故答案为: ;
; ;
; +Br2→
+Br2→ ,
,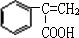 +CH3OH
+CH3OH| 浓硫酸 |
| △ |
 +H2O,
+H2O, +Br2→
+Br2→ ;
;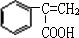 +CH3OH
+CH3OH| 浓硫酸 |
| △ |
 +H2O;
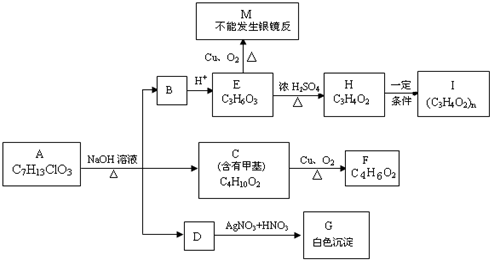
+H2O; )具有相同官能团的,属于芳香烃的同分异构体有:
)具有相同官能团的,属于芳香烃的同分异构体有: ,
, .
.


科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
| B | NaOH | HCl | NH4Cl | Na2O | CO |
| C | NH3?H2O | CH3COOH | NaCl | Na2O2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
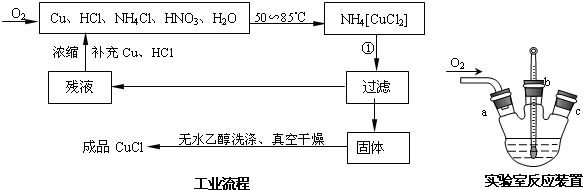
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
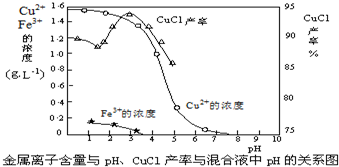
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(Min) 浓度(mol?L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2+3H2?2NH3 |
| B、H2 (g)+I2 (g)?2HI(g) |
| C、2NO2?N2O4 |
| D、HCl+NaOH?NaCl+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com