
【题目】一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
氧化反应为Cu﹣2e﹣═Cu2+ , 还原反应为2Fe3++2e﹣═2Fe2+ , 原电池的电极反应式也可利用此方法书写.请回答下列问题: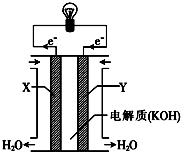
(1)已知某一反应的两个“半反应式”分别为CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O和4H2O+2O2+8e﹣═8OH﹣ . 请写出该反应的总反应式:
(2)如图为氢氧燃料电池的构造示意图,已知X极的电极反应式为2H2﹣4e﹣+4OH﹣═4H2O,则X极为电池的(填“正”或“负”)极,Y极的电极反应式为 . 当电池工作一定时间后,电解质溶液的碱性(填“增强、减弱或不变”)
(3)有人以化学反应:2Zn+O2+4H+═2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作.则该原电池负极的电极反应式为 , 正极的电极反应式为 , 若电池工作过程中有5.6L O2(标准状况下)参于反应,则转移电子的物质的量为
【答案】
(1)CH4+2OH﹣+2O2═CO32﹣+3H2O
(2)负;O2+2H2O+4e﹣═4OH﹣;减弱
(3)2Zn﹣4e﹣═2Zn2+;O2+4H++4e﹣═2H2O;1mol
【解析】解:(1)已知甲烷燃料电池的半反应式分别为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O,2O2+4H2O+8e﹣═8OH﹣ , 原电池中正负极电极方程式相加即可得到总反应,则总反应式:CH4+2OH﹣+2O2═CO32﹣+3H2O,所以答案是:CH4+2OH﹣+2O2═CO32﹣+3H2O;
(2.)X极的电极反应式为2H2﹣4e﹣+4OH﹣=2H2O,则通入氢气的X极为负极,发生氧化反应,并可判断溶液呈碱性,碱性溶液中正极Y极发生还原反应,电极反应为O2﹣4e﹣+2H2O=4OH﹣;氢氧燃料电池的实质是在一定条件下形成了原电池,其实质仍然是O2把H2氧化,电池总反应为2H2+O2=2H2O,生成了水将碱性溶液稀释,所以电解质溶液的碱性减弱,所以答案是:负;O2+2H2O+4e﹣═4OH﹣;减弱;
(3.)根据电池反应式知,锌失电子发生氧化反应,所以锌作负极,电极反应式为:2Zn﹣4e﹣═2Zn2+ , 氧气在正极得电子发生还原反应,电极反应式为:O2+4H++4e﹣═2H2O,若电池工作过程中有5.6L O2(标准状况下)即 ![]() =0.25mol参于反应,则转移电子的物质的量为0.25mol×4=1mol;所以答案是:2Zn﹣4e﹣═2Zn2+;O2+4H++4e﹣═2H2O;1mol.
=0.25mol参于反应,则转移电子的物质的量为0.25mol×4=1mol;所以答案是:2Zn﹣4e﹣═2Zn2+;O2+4H++4e﹣═2H2O;1mol.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
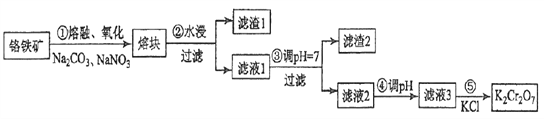
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_________。
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_________。
(2)滤渣1中含量最多的金属元素是_______,滤渣2的主要成分是__________及含硅杂质。
(3)步骤④调滤液2的pH使之变______(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。
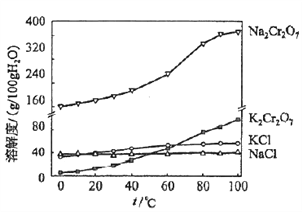
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某原电池装置,电池总反应为2Ag+Cl2=2AgCl.下列说法正确的是( ) 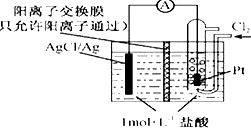
A.正极反应为AgCl+e﹣═Ag+Cl﹣
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e﹣时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间主要的相互作用依次是
A.分子间作用力;分子间作用力;非极性键
B.分子间作用力;分子间作用力;极性键
C.分子间作用力;极性键;分子间作用力
D.分子间作用力;分子间作用力;非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n 克,则下列有关该实验的说法中正确的有:
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为![]() mol
mol
③反应过程中转移的电子数为![]() mol
mol
④生成NO气体的体积为![]() L
L
⑤与合金反应反应的硝酸的物质的量为![]() mol
mol
A. 2项 B. 3项 C. 4项 D. 5项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com