
ЎҫМвДҝЎҝТ»¶ЁОВ¶ИМхјюПВ,N2УлH2·ҙУҰЙъіЙNH3өД№эіМЦРДЬБҝұд»ҜЗъПЯИзПВНјЎЈ

(1)ЗъПЯ_______(МоЎ°aЎ°»тЎ°bЎұ")КЗјУИлҙЯ»ҜјБКұөДДЬБҝұд»ҜЗъПЯ, NЎФNјьДЬОӘ946kJ/mol,N-HјьДЬОӘ391kJ/mol,ФтH-HҪЁДЬОӘ_______kJ/molЎЈ
(2)Л®өДЧФЕјөзАл·ҪіМКҪОӘ2H2O![]() H3O++OH-,Тә°ұТІДЬ·ўЙъЧФЕјөзАлЈ¬РҙіцТә°ұөДЧФЕјөзАл·ҪіМ·ҙУҰ№эіМКҪ_________;NH2-өзЧУКҪОӘ________ЎЈ
H3O++OH-,Тә°ұТІДЬ·ўЙъЧФЕјөзАлЈ¬РҙіцТә°ұөДЧФЕјөзАл·ҪіМ·ҙУҰ№эіМКҪ_________;NH2-өзЧУКҪОӘ________ЎЈ
(3)ҙОВИЛбДЖИЬТәЦРАлЧУЕЁ¶ИУЙҙуөҪРЎЛіРтОӘ________;Ҫ«°ұЖшНЁИлөҪҙОВИЛбДЖИЬТәЦРҝЙЦЖөГБӘ°ұ(N2H4),Рҙіц·ҙУҰөДАлЧУ·ҪіМКҪ__________;УГЛДСх»Ҝ¶юөӘЧчЦъИјјБ,БӘ°ұҝЙЧч»рјэИјБПЎЈТСЦӘ:N2(g)+2O2(g)= 2NO2(g),ҰӨH,= +67.7kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ҰӨH2=-534kJ/mol;N2O4(g)=2NO2(g),ҰӨH3=+ 57kJ/mol,РҙіцЖшМ¬өДБӘ°ұФЪЛДСх»Ҝ¶юөӘЖшМеЦРИјЙХЙъіЙБҪЦЦОЮОЫИҫЖшМ¬ІъОпөДИИ»ҜС§·ҪіМКҪ______ЎЈ
(4)Ҫ«2.04mol/LөД°ұЛ®Ул0.02mo/LөДПхЛбТшИЬТәөИМе»э»мәПөГөҪ»мәПИЬТәЈ¬»мәПМеПөЦРҙжФЪЖҪәв:Ag+(aq) +2NH3ЎӨH2O(aq) ![]() Ag(NH3)2+(aq)+2H2O(1),ЖҪәвіЈКэұнҙпКҪK=_________;ФЪіЈОВКұK=1ЎБ107,УЙУЪ°ұЛ®№эБҝ,ТшАлЧУјёәх·ҙУҰНкИ«,јЖЛгҙЛКұ»мәПИЬТәЦРc(Ag+)=_________mol/ LЎЈ
Ag(NH3)2+(aq)+2H2O(1),ЖҪәвіЈКэұнҙпКҪK=_________;ФЪіЈОВКұK=1ЎБ107,УЙУЪ°ұЛ®№эБҝ,ТшАлЧУјёәх·ҙУҰНкИ«,јЖЛгҙЛКұ»мәПИЬТәЦРc(Ag+)=_________mol/ LЎЈ
Ўҫҙр°ёЎҝ b 436 2NH3![]() NH4++NH2-
NH4++NH2- ![]() c(Na+)>c(ClO-)>c(OH-)>c(H+) 2NH3+ClO-=N2H4+Cl-+H2O 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);ҰӨH= -1078.7kJ/mol
c(Na+)>c(ClO-)>c(OH-)>c(H+) 2NH3+ClO-=N2H4+Cl-+H2O 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);ҰӨH= -1078.7kJ/mol ![]() 1ЎБ10-9
1ЎБ10-9
ЎҫҪвОцЎҝКФМв·ЦОцЈә(1)јУИлҙЯ»ҜјБДЬҪөөН·ҙУҰ»о»ҜДЬЈ»мКұд=·ҙУҰОпөДЧЬјьДЬ-ЙъіЙОпөДЧЬјьДЬЈ»(2)ёщҫЭЛ®өДЧФЕјөзАлРҙТә°ұөДЧФЕјөзАл·ҪіМКҪЈ»NH2-ЦРөӘФӯЧУЧоНвІгКЗ8өзЧУҪб№№Ј»(3)ҙОВИЛбДЖКЗЗҝјоИхЛбСОЈ¬ҙОВИЛбёщАлЧУЛ®ҪвЈ¬ИЬТәіКјоРФЈ»°ұЖшУлҙОВИЛбДЖИЬТә·ҙУҰСх»Ҝ»№Фӯ·ҙУҰЙъіЙВИ»ҜДЖәНN2H4Ј»ёщҫЭёЗЛ№¶ЁВЙКйРҙЖшМ¬өДБӘ°ұФЪЛДСх»Ҝ¶юөӘЖшМеЦРИјЙХЙъіЙөӘЖшәНЛ®ХфЖшөДИИ»ҜС§·ҪіМКҪЈ»(4)№ММеЎўҙҝТәМеІ»ДЬјЖИлЖҪәвіЈКэұнҙпКҪЈ»ёщҫЭ»ҜС§·ҪіМКҪЈ¬2.04mol/LөД°ұЛ®Ул0.02mo/LөДПхЛбТшИЬТәөИМе»э»мәПөГөҪ»мәПИЬТәЈ¬c(NH3ЎӨH2O)= ![]() mo/LЈ¬ЙъіЙc(Ag(NH3)2+)=
mo/LЈ¬ЙъіЙc(Ag(NH3)2+)=![]() =0.01 mo/LЈ»ёщҫЭ
=0.01 mo/LЈ»ёщҫЭ![]() = K=1ЎБ107јЖЛгc(Ag+)ЎЈ
= K=1ЎБ107јЖЛгc(Ag+)ЎЈ
ҪвОцЈә(1)јУИлҙЯ»ҜјБДЬҪөөН·ҙУҰ»о»ҜДЬЈ¬ЛщТФЗъПЯbКЗјУИлҙЯ»ҜјБКұөДДЬБҝұд»ҜЗъПЯЈ»ёщҫЭНјПсҝЙЦӘN2(g)+3H2(g)![]() 2NH3(g)
2NH3(g) ![]() =-92 kJ/molЈ»ЙиH-HҪЁДЬОӘxkJ/molЈ¬ёщҫЭмКұд=·ҙУҰОпөДЧЬјьДЬ-ЙъіЙОпөДЧЬјьДЬЈ¬-92 kJ/mol=946kJ/mol+3x-
=-92 kJ/molЈ»ЙиH-HҪЁДЬОӘxkJ/molЈ¬ёщҫЭмКұд=·ҙУҰОпөДЧЬјьДЬ-ЙъіЙОпөДЧЬјьДЬЈ¬-92 kJ/mol=946kJ/mol+3x-![]() 391kJ/molЈ¬x=436 kJ/molЈ»(2)ёщҫЭЛ®өДЧФЕјөзАлЈ¬Тә°ұөДЧФЕјөзАл·ҪіМКҪКЗ2NH3
391kJ/molЈ¬x=436 kJ/molЈ»(2)ёщҫЭЛ®өДЧФЕјөзАлЈ¬Тә°ұөДЧФЕјөзАл·ҪіМКҪКЗ2NH3![]() NH4++NH2-Ј»NH2-ЦРөӘФӯЧУЧоНвІгКЗ8өзЧУҪб№№Ј¬NH2-өДөзЧУКҪОӘ
NH4++NH2-Ј»NH2-ЦРөӘФӯЧУЧоНвІгКЗ8өзЧУҪб№№Ј¬NH2-өДөзЧУКҪОӘ![]() Ј»(3)ҙОВИЛбДЖКЗЗҝјоИхЛбСОЈ¬ҙОВИЛбёщАлЧУЛ®ҪвЈ¬ИЬТәіКјоРФЈ¬ЛщТФАлЧУЕЁ¶ИУЙҙуөҪРЎЛіРтОӘc(Na+)>c(ClO-)>c(OH-)>c(H+)Ј»°ұЖшУлҙОВИЛбДЖИЬТә·ҙУҰСх»Ҝ»№Фӯ·ҙУҰЙъіЙВИ»ҜДЖәНN2H4Ј¬·ҙУҰАлЧУ·ҪіМКҪКЗ2NH3+ClO-=N2H4+Cl-+H2OЈ»
Ј»(3)ҙОВИЛбДЖКЗЗҝјоИхЛбСОЈ¬ҙОВИЛбёщАлЧУЛ®ҪвЈ¬ИЬТәіКјоРФЈ¬ЛщТФАлЧУЕЁ¶ИУЙҙуөҪРЎЛіРтОӘc(Na+)>c(ClO-)>c(OH-)>c(H+)Ј»°ұЖшУлҙОВИЛбДЖИЬТә·ҙУҰСх»Ҝ»№Фӯ·ҙУҰЙъіЙВИ»ҜДЖәНN2H4Ј¬·ҙУҰАлЧУ·ҪіМКҪКЗ2NH3+ClO-=N2H4+Cl-+H2OЈ»
ўЩN2(g)+2O2(g)= 2NO2(g),ҰӨH,= -67.7kJ/molЈ»
ўЪN2H4(g)+O2(g)=N2(g)+2H2O(g) ҰӨH2=-534kJ/molЈ»
ўЫ N2O4(g)=2NO2(g),ҰӨH3=+ 57kJ/mol,
ёщҫЭёЗЛ№¶ЁВЙўЪЎБ2Ј«ўЫЈӯўЩөГ2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);ҰӨH= -1078.7kJ/molЈ»(4) Ag+(aq) +2NH3ЎӨH2O(aq) ![]() Ag(NH3)2+(aq)+2H2O(1),ЖҪәвіЈКэұнҙпКҪK=
Ag(NH3)2+(aq)+2H2O(1),ЖҪәвіЈКэұнҙпКҪK=![]() Ј»ёщҫЭ»ҜС§·ҪіМКҪЈ¬2.04mol/LөД°ұЛ®Ул0.02mo/LөДПхЛбТшИЬТәөИМе»э»мәПөГөҪ»мәПИЬТәЈ¬c(NH3ЎӨH2O)=
Ј»ёщҫЭ»ҜС§·ҪіМКҪЈ¬2.04mol/LөД°ұЛ®Ул0.02mo/LөДПхЛбТшИЬТәөИМе»э»мәПөГөҪ»мәПИЬТәЈ¬c(NH3ЎӨH2O)= ![]() mo/LЈ¬ЙъіЙc(Ag(NH3)2+)=
mo/LЈ¬ЙъіЙc(Ag(NH3)2+)=![]() =0.01 mo/LЈ»
=0.01 mo/LЈ» ![]() =
=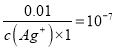 Ј¬c(Ag+)=1ЎБ10-9ЎЈ
Ј¬c(Ag+)=1ЎБ10-9ЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЧоҪьГА№ъҝЖС§јТКөК©БЛТ»ПоЎ°МмҝХВМЙ«јЖ»®ЎұЈ¬НЁ№эөзҪв¶юСх»ҜМјөГөҪМјІДБП(Іҝ·ЦФӯАнИзНјЛщКҫ)Ј¬ІўАыУГөГөҪөДМјІДБПЙъіЙп®АлЧУөзіШЎЈПВБРЛө·ЁХэИ·өДКЗ

A. НјЦРДЬБҝЧӘ»Ҝ·ҪКҪЦ»УРТ»ЦЦ
B. Сфј«өДөзј«·ҙУҰКҪОӘ2CO32--4e-=2CO2Ўь+O2Ўь
C. Иф·ҙУҰЦРЧӘТЖ1mole-Ј¬ФтАнВЫЙППыәДCO32-0.5mol
D. өұЙъіЙ12gМјІДБПКұЈ¬ҝЙКХјҜөҪ22.4LO2
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝөз¶ЖРРТөІъЙъөДЛбРФә¬ёх·ПЛ®¶Ф»·ҫіУРОЫИҫЈ¬ЖдЦРЛщә¬өДCr(VI)КЗЦчТӘОЫИҫОпЈ¬ҝЙІЙУГ¶аЦЦ·Ҫ·ЁҙҰАнҪ«ЖдіэИҘЎЈ
ІйФДЧКБПҝЙЦӘЈә
ўЩФЪЛбРФ»·ҫіПВЈ¬CrЈЁVIЈ©НЁіЈТФCr2O72-өДРОКҪҙжФЪЈ¬Cr2O72-+H2O ![]() 2CrO42-+2H+
2CrO42-+2H+
ўЪCr2O72-өДСх»ҜДЬБҰЗҝУЪCrO42-
ўЫіЈОВПВЈ¬Іҝ·ЦСфАлЧУТФЗвСх»ҜОпРОКҪіБөнКұИЬТәөДpHИзПВұнЈә
СфАлЧУ | Fe3+ | Fe2+ | Cr3+ |
ҝӘКјіБөнөДpH | 1.9 | 7.0 | 4.3 |
іБөнНкИ«өДpH | 3.2 | 9.0 | 5.6 |
IЈ®ёҜКҙөзіШ·Ё
ЈЁ1Ј©ПтЛбРФә¬ёх·ПЛ®ЦРН¶·Е·ПМъРјәНҪ№МҝЈ¬АыУГФӯөзіШФӯАн»№ФӯCr(VI)ЎЈПВБР№ШУЪҪ№МҝөДЛө·ЁХэИ·өДКЗ________ЈЁМоЧЦДёРтәЕЈ©ЎЈ
a. ЧчФӯөзіШөДХэј« b. ФЪ·ҙУҰЦРЧч»№ФӯјБ c. ұнГжҝЙДЬУРЖшЕЭІъЙъ
IIЈ®өзҪв»№Фӯ·Ё
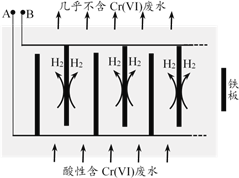
ПтЛбРФә¬ёх·ПЛ®ЦРјУИлККБҝNaCl№ММеЈ¬ТФFeОӘөзј«өзҪвЈ¬ҫӯ№эТ»¶ОКұјдЈ¬УРCr(OH)3әНFe(OH)3іБөнЙъіЙЕЕіцЈ¬ҙУ¶шК№·ПЛ®ЦРёхә¬БҝөНУЪЕЕ·ЕұкЧјЎЈЧ°ЦГИзУТНјЛщКҫЎЈ
ЈЁ2Ј©Aј«Б¬ҪУөзФҙөД________ј«Ј¬Aј«ЙПөДөзј«·ҙУҰКҪКЗ________ЎЈ
ЈЁ3Ј©өзҪвҝӘКјКұЈ¬Bј«ЙПЦчТӘ·ўЙъөДөзј«·ҙУҰОӘ2H++2e-=H2ЎьЈ¬ҙЛНв»№УРЙЩБҝCr2O72-ФЪBј«ЙПЦұҪУ·ЕөзЈ¬ёГ·ҙУҰөДөзј«·ҙУҰКҪОӘ________ЎЈ
ЈЁ4Ј©өзҪв№эіМЦРЈ¬ИЬТәөДpHІ»Н¬КұЈ¬НЁөзКұјдЈЁtЈ©УлИЬТәЦРCrФӘЛШИҘіэВКөД№ШПөИзУТНјЛщКҫЎЈ

ўЩУЙНјЦӘЈ¬өзҪв»№Фӯ·ЁУҰІЙИЎөДЧојСpH·¶О§ОӘ________ЎЈ
a. 2 ~ 4 b. 4 ~ 6 c. 6 ~ 10
ўЪҪвКНЗъПЯIәНЗъПЯIVИҘіэВКөНөДФӯТтЈә________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝіЈОВПВЈ¬УГ0.1000molЎӨL1NaOHИЬТәөО¶Ё20.00mL0.1000mol ЎӨ L1CH3COOHИЬТәЈ¬өО¶Ё№эіМЦРИЬТәpHЛжNaOHИЬТәМе»эөДұд»ҜјыПВНјЎЈФтТФПВЛө·ЁХэИ·өДКЗ

A. өгўЫЛщКҫИЬТәЦРЈәc(Na+)ЈҪc(CH3COOH)+c(CH3COOЁD)
B. өгўЩЛщКҫИЬТәЦРЈәc(CH3COOЁD)+c(OHЁD)ЈҪc(CH3COOH)+c(H+)
C. өгўЫЛщКҫИЬТәЦРЈәc(Na+)Јҫc(OHЁD)Јҫc(CH3COOЁD)Јҫc(H+)
D. өО¶Ё№эіМЦРІ»ҝЙДЬіцПЦЈәc(CH3COOH)Јҫc(CH3COOЁD)Јҫc(H+)Јҫc(Na+)Јҫc(OHЁD)
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЧКБППФКҫЈәРҝУлЕЁБтЛб№ІИИіэЙъіЙ¶юСх»ҜБтЖшМеНвЈ¬»№ҝЙДЬІъЙъЗвЖшЈ»ФЪјУИИөДМхјюПВ¶юСх»ҜБтҝЙұ»CuOСх»ҜЎЈОӘСйЦӨёГ·ҙУҰөДЖшМеІъОпј°РФЦКЈ¬ЙијЖБЛИзПВНјЛщКҫөДКөСйЧ°ЦГЈЁЙиРҝУлЕЁБтЛб№ІИИКұІъЙъөДЖшМеОӘXЈ©ЎЈ

(1)ЙПКцЧ°ЦГөДБ¬ҪУЛіРтОӘЈәЖшМеXЎъAЎъ____ЎъAЎъ Ўъ Ўъ ЎъD;
(2)·ҙУҰҝӘКјә󣬹۲мөҪөЪТ»ёцЧ°ЦГAЦРөДЖ·әмИЬТәНКЙ«Ј¬КөСйҪбКшәуИЎККБҝёГИЬТәУЪКФ№ЬЦРІўјУИИЈ¬ПЦПуОӘ_______________________________________Ј»
(3)Ч°ЦГ CЦРөДNaOHИЬТәДЬУГПВБР____ҙъМжЈ»
a.ЛбРФKMnO4ИЬТә b.CaCl2ИЬТә c.ұҘәНNaHSO3ИЬТә
Ч°ЦГDөДЧчУГКЗ____________________________
(4)ЖшМеXЦРҝЙДЬә¬УРH2өДФӯТтКЗ____________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЙиNAОӘ°ў·ьјУөВВЮіЈКэөДЦөЈ¬ПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
A. іЈОВіЈС№ПВЈ¬23g NO2ә¬УРNAёцСхФӯЧУ
B. ұкЧјЧҙҝцПВЈ¬22.4L H2Oә¬УРNAёцH2O·ЦЧУ
C. 1mol N2ә¬2NAёцN2·ЦЧУ
D. 0.1mol/LөДBa(OH)2ИЬТәЦРOHЈӯөДёцКэОӘ0.2NAёц
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіИЭ»эОӘ1LөДГЬұХИЭЖчЦРНЁИл1mol CO2әН3mol H2Ј¬·ўЙъ·ҙУҰЈәCO2(g)Ј«3H2(g)![]() CH3OH(g)Ј«H2O(g) ҰӨHЈј0ЎЈПВБРУР№ШЛө·ЁХэИ·өДКЗ
CH3OH(g)Ј«H2O(g) ҰӨHЈј0ЎЈПВБРУР№ШЛө·ЁХэИ·өДКЗ
A. ёГ·ҙУҰФЪёЯОВПВІЕДЬЧФ·ўҪшРР
B. ФЩјУИлТ»¶ЁБҝCO2Ј¬Фтn(CH3OH)/n(CO2)јхРЎ
C. ОВ¶ИЙэёЯЈ¬·ҙУҰөДЖҪәвіЈКэKФцҙу
D. өұCO2әНH2ЧӘ»ҜВКПаөИКұЈ¬ёГ·ҙУҰҙпөҪ»ҜС§ЖҪәв
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝМјәНөӘөД»ҜәПОпУлИЛАаЙъІъЎўЙъ»оГЬЗРПа№ШЈ®

ЈЁ1Ј©ФЪТ»әгОВЎўәгИЭГЬұХИЭЖчЦР·ўЙъ·ҙУҰЈәNi ЈЁsЈ©+4COЈЁgЈ©![]() NiЈЁCOЈ©4ЈЁgЈ©Ј¬ЎчHЈј0Ј®АыУГёГ·ҙУҰҝЙТФҪ«ҙЦДшЧӘ»ҜОӘҙҝ¶Иҙп99.9%өДёЯҙҝДшЈ®ПВБРЛө·ЁХэИ·өДКЗ ЈЁМоЧЦДёұаәЕЈ©Ј®
NiЈЁCOЈ©4ЈЁgЈ©Ј¬ЎчHЈј0Ј®АыУГёГ·ҙУҰҝЙТФҪ«ҙЦДшЧӘ»ҜОӘҙҝ¶Иҙп99.9%өДёЯҙҝДшЈ®ПВБРЛө·ЁХэИ·өДКЗ ЈЁМоЧЦДёұаәЕЈ©Ј®
AЈ®ФцјУNiөДБҝҝЙМбёЯCOөДЧӘ»ҜВКЈ¬NiөДЧӘ»ҜВКҪөөН
BЈ®ЛхРЎИЭЖчИЭ»эЈ¬ЖҪәвУТТЖЈ¬ЎчHјхРЎ
CЈ®·ҙУҰҙпөҪЖҪәвәуЈ¬ідИлCOФЩҙОҙпөҪЖҪәвКұЈ¬COөДМе»э·ЦКэҪөөН
DЈ®өұ4vХэ[NiЈЁCOЈ©4]=vХэЈЁCOЈ©Кұ»тИЭЖчЦР»мәПЖшМеГЬ¶ИІ»ұдКұЈ¬¶јҝЙЛөГч·ҙУҰТСҙп»ҜС§ЖҪәвЧҙМ¬
ЈЁ2Ј©COУлДш·ҙУҰ»бФміЙә¬ДшҙЯ»ҜјБөДЦР¶ҫЈ®ОӘ·АЦ№ДшҙЯ»ҜјБЦР¶ҫЈ¬№ӨТөЙПіЈУГSO2Ҫ«COСх»ҜЈ¬¶юСх»ҜБтЧӘ»ҜОӘөҘЦКБтЈ®
ТСЦӘЈәCOЈЁgЈ©+1/2QUOTE\*MERGEFORMATO2ЈЁgЈ©=CO2ЈЁgЈ©ЎчH=©ҒQ1 kJmol©Ғ1
SЈЁsЈ©+O2ЈЁgЈ©=SO2ЈЁgЈ©ЎчH=©ҒQ2 kJmol©Ғ1
ФтSO2ЈЁgЈ©+2CO ЈЁgЈ©=SЈЁsЈ©+2CO2ЈЁgЈ©ЎчH= Ј®
ЈЁ3Ј©¶ФУЪ·ҙУҰЈә2NOЈЁgЈ©+O2ЁT2NO2ЈЁgЈ©Ј¬ПтДіИЭЖчЦРідИл10molөДNOәН10molөДO2Ј¬ФЪЖдЛыМхјюПаН¬КұЈ¬·ЦұрІвөГNOөДЖҪәвЧӘ»ҜВКФЪІ»Н¬С№ЗҝЈЁP1ЎўP2Ј©ПВЛжОВ¶Иұд»ҜөДЗъПЯЈЁИзНј1Ј©Ј®
ўЩұИҪПP1ЎўP2өДҙуРЎ№ШПөЈә Ј®
ўЪ700ЎжКұЈ¬ФЪС№ЗҝОӘP2КұЈ¬јЩЙиИЭЖчОӘ1LЈ¬ФтФЪёГМхјюЖҪәвіЈКэөДКэЦөОӘ ЈЁЧојт·ЦКэРОКҪЈ©
ЈЁ4Ј©NO2ЎўO2әНИЫИЪNaNO3ҝЙЦЖЧчИјБПөзіШЈ¬ЖдФӯАнИзНј2ЛщКҫЈ®ёГөзіШФЪК№УГ№эіМЦРКҜД«Iөзј«ЙПЙъіЙСх»ҜОпYЈ¬ДЗГҙКҜД«IIј«өзј«·ҙУҰКҪОӘ Ј®ИфёГИјБПөзіШК№УГТ»¶ОКұјдә󣬹ІКХјҜөҪ20mol YЈ¬ФтАнВЫЙПРиТӘПыәДұкЧјЧҙҝцПВСхЖшөДМе»эОӘ LЈ®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҪ«өИОпЦКөДБҝЕЁ¶ИЎўөИМе»эөДБтЛбУлЙХјоИЬТә»мәПәуЈ¬өОИлЧПЙ«КҜИпКФТәЈ¬ИЬТәіК( )
A.ЧПЙ«B.әмЙ«C.А¶Й«D.ОЮЙ«
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com