
【题目】如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有3.2g甲醇参加反应且③电极增重(假设工作时无能量损失).请回答下列问题: 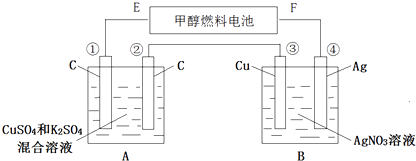
(1)F电极的名称是 , E电极的反应式: .
(2)④电极的反应式: , 通电一段时间后B池pH(填“变大”“变小”“不变”).
(3)若A池中原混合液的体积为500mL,CuSO4、K2SO4浓度均为0.3mol/L,电解过程中A池中共收集到标准状况下的气体L,①、③电极析出固体物质的量之比 .
(4)欲使通电后的溶液恢复至原状,可加入一种物质是(写名称).
【答案】
(1)正极; CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O
(2)Ag﹣e﹣=Ag+;不变
(3)6.72;1:4
(4)氢氧化铜
【解析】解:(1)对A、B装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重,则说明③电极上银离子得电子析出银,则③是电解池阴极,所以④②是阳极,①是阴极,原电池中E是负极,F是正极,负极上甲醇失电子生成碳酸根离子,则负极电极方程式为:CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O;
所以答案是:正极;CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O; (2)电解池中,③上银离子得电子生成银单质,④电极上银失电子生成银离子进入溶液,电极反应式为:Ag﹣e﹣=Ag+,B装置中阴极上银离子得电子,阳极上Ag失电子生成银离子,溶液中银离子浓度不变,所以溶液的pH不变;
所以答案是:Ag﹣e﹣=Ag+;不变;(3)设3.2g甲醇反应转移电子的物质的量是x,
CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O | 转移电子 |
32g | 6mol |
3.2g | x |
x= ![]() =0.6mol
=0.6mol
若A池中原混合液的体积为500mL,CuSO4、K2SO4浓度均为0.3mol/L,则铜离子的物质的量为0.3mol/L×0.5L=0.15mol,当铜离子完全析出时,铜离子得到电子的物质的量=0.15mol×2=0.3mol<0.6mol,所以电解混合溶液时,阴极上先析出铜后析出氢气,阳极上析出氧气,但得失电子的物质的量都是0.6mol,
设阴极上析出氢气的物质的量是y,阳极上析出氧气的物质的量是z,
则0.15mol×2+2y=4z=0.6mol,y=0.15mol,z=0.15mol,所以A池中共收集到的气体的物质的量是(0.15+0.15)mol=0.3mol,则气体体积=0.3mol×22.4L/mol=6.72L,①上铜离子得电子析出金属铜,铜离子的物质的量为0.3mol/L×0.5L=0.15mol,③上银离子得电子生成银单质,根据电子守恒,转移0.6mol电子析出金属银是0.6mol,两个电极析出固体物质的量之比为1:4,
所以答案是:6.72; 1:4;(4)A中电解生成的物质,阳极生成氧气,阴极上生成氢气和Cu,所以欲使通电后的溶液恢复至原状,可加入一种物质是氢氧化铜;
所以答案是:氢氧化铜.


科目:高中化学 来源: 题型:
【题目】有关 ![]() 分子结构的下列叙述中正确的是( ) ①除苯环外的其余碳原子有可能都在一条直线上
分子结构的下列叙述中正确的是( ) ①除苯环外的其余碳原子有可能都在一条直线上
②除苯环外的其余碳原子不可能都在一条直线上
③12个碳原子不可能都在同一平面上
④12个碳原子有可能都在同一平面上.
A.①②
B.②③
C.①③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温常压下,已知:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH1
4Al(s)+3O2(g)=2Al2O3(s) ΔH2
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是
A. ΔH3=1/2(ΔH1+ΔH2) B. ΔH3=ΔH2-ΔH1
C. ΔH3=2(ΔH2+ΔH1) D. ΔH3=1/2 (ΔH2-ΔH1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.纯净物中一定存在化学键
B.阴、阳离子间通过静电引力而形成的化学键叫做离子键
C.只有金属元素和非金属元素化合时才能形成离子键
D.离子化合物中可能含共价键,共价化合物中不含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W都是中学化学中常见物质,其中X、Y、Z均含有同一种元素,在一定条件下相互转化关系如下(部分生成物已略去)。
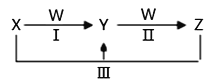
(1)若X是烧碱,Z是小苏打。
① W的分子式是____________________。
② 在水溶液中,反应Ⅲ的离子方程式是_________________________________。
(2)若X是氯气、Z是氯化亚铁。
① 在水溶液中,反应Ⅲ的离子方程式是_________________________________。
② Y可作净水剂,其原理是_________________________(用离子方程式表示)。在使用时发现Y不能使酸性废水中的悬浮物沉降除去,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况可能引起大气污染的是( )
①煤的燃烧 ②工业废气任意排放 ③燃放鞭炮 ④飞机、汽车尾气的排放
A.只有①②
B.只有②④
C.只有①②③
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】代沟是化学老师说什么你都不听,代价就是这道题你什么都不会!
I. A、B、C、D四种物质均含有同一种元素。A是常见的金属单质,C的水溶液呈黄色。A、B、C、D之间在一定条件下有如图所示转化关系:
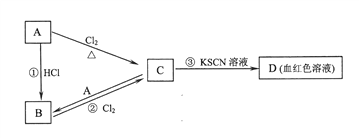
请回答下列问题:
(1)A的化学式是_____________________。
(2)反应①的反应类型为_____________反应(选填“化合”、“分解”、“置换”、“复分解”)。
(3)反应②的化学方程式是___________________________。
(4)C的水溶液与NaOH溶液混合后发生反应的离子方程式是______________________。
II. 实验室可以用如图所示装置制取乙酸乙酯。请回答下列问题:
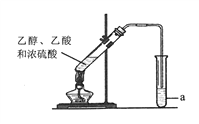
(1)a试管中盛放的是饱和碳酸钠溶液,制得的乙酸乙酯在饱和碳酸钠溶液的________(填“上”或“下”)层。
(2)制取乙酸乙酯的化学方程式是________________,该反应属于_______________反应(填反应类型)。左边试管中在加热前往往加入 ____________以用于防爆沸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com