
 NaHSO4+HBr
NaHSO4+HBr C2H5Br+H2O
C2H5Br+H2O| 密度/g?mL-1 | 沸点/℃ | 溶解性 | |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断;

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| △ |
| 密度/g?mL-1 | 沸点/℃ | 溶解性 | |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(一) 欲配制500mL0.2mol/LNa2CO3溶液,回答下列问题:
(1)应称取 g Na2CO3·10H2O。
(2)配制该溶液所用的仪器有 ____ 。
(3)下列操作使所配溶液浓度偏低的是( )
A、容量瓶未干燥即用来配制溶液 B、往容量瓶转移溶液时有少量液体溅出
C、未洗涤溶解固体的烧杯 D、定容时,仰视刻度线
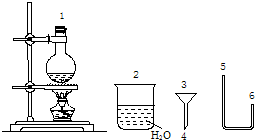
(二)某化学小组在实验室用下图提供的仪器制备溴乙烷。
已知:
①反应原理:NaBr+H2SO4(较浓)△=== NaHSO4+HBr
HBr+C2H5OHC2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO4 30mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
|
| 密度/g·mL-1 | 沸点/℃ | 溶解性 |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
回答下列问题:
(4)连接上述仪器的顺序是:1接( )接( )接(4 )接( 3 )接( )(填数字)。你认为反应后溴乙烷在 (填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是 (写化学式),除去该杂质的试剂和方法是 ,为了减少该副产物的生成,根据加入的反应物,本实验采取了 _________________________________________________________的措施。
查看答案和解析>>
科目:高中化学 来源:2010年广东省执信中学高三上学期期中考试化学卷 题型:填空题
(一) 欲配制500mL0.2mol/LNa2CO3溶液,回答下列问题:
(1)应称取 g Na2CO3·10H2O。
(2)配制该溶液所用的仪器有 ____ 。
(3)下列操作使所配溶液浓度偏低的是( )
| A.容量瓶未干燥即用来配制溶液 | B.往容量瓶转移溶液时有少量液体溅出 |
| C.未洗涤溶解固体的烧杯 | D.定容时,仰视刻度线 |

| | 密度/g·mL-1 | 沸点/℃ | 溶解性 |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com