
【题目】下列试剂的保存方法中不正确的是
A.少量的钠保存在煤油中B.新制的氯水保存在棕色试剂瓶中
C.保存硫酸亚铁溶液时需加少量铁粉D.NaOH溶液保存在带玻塞的细口试剂瓶中
【答案】D
【解析】
A.金属钠很活泼,容易与空气中的氧气反应,因此,钠的保存需隔绝空气。钠的密度大于煤油的密度,且钠与煤油不反应,所以,实验室将少量的钠保存在煤油中。故A正确;
B.氯水中的次氯酸不稳定,光照条件下发生分解反应,因此,新制的氯水要保存在棕色试剂瓶中,故B正确;
C.亚铁离子具有较强的还原性,容易被空气中的氧气氧化为铁离子,保存硫酸亚铁溶液时加少量铁粉可起到防止亚铁离子氧化变质的作用,原理是:![]() ,故C正确;
,故C正确;
D.玻璃的主要成分是二氧化硅,它是一种酸性氧化物,可与氢氧化钠溶液反应生成具有粘性的硅酸钠溶液,能将玻璃塞与瓶口粘结在一起,因此,盛氢氧化钠溶液的试剂瓶不能用玻璃塞,要用橡皮塞,故D错误;
答案选D。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知:CH3COOH、H2CO3、HNO2的电离常数(25℃)分别为Ka=1.8×10-5;Ka1=4.3×10-7、Ka2=5.6×10-11;Ka=5.0×10-4请回答下列问题:
⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号。)
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变
⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中:
c(CH3COO-)/c(CH3COOH)=____
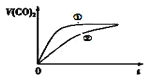
⑶常温下,将20mL 0.1mol/L CH3COOH溶液 和20mL 0.1mol/LHNO2 溶液分别与 20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,则表示CH3COOH溶液的曲线是_______(填写序号);
⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示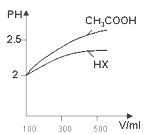 ,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:
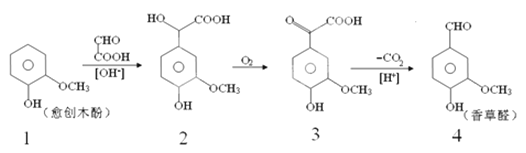
下列说法正确的是( )
A. 反应1→2属于加成反应,且生成的化合物2具有一个手性碳原子
B. 化合物2在一定条件下可发生消去反应
C. 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
D. 等物质的量四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比为1:3:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了对锂离子电池方面的研究作出贡献的约翰·B·古迪纳夫(John B.Goodenough)等三位科学家。已知可充电镍酸锂离子电池的工作原理如图所示,其总反应为:![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
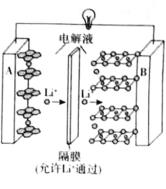
A.放电时,A电极为![]() 作原电池负极
作原电池负极
B.放电时,B电极反应式为![]()
C.充电时,A电极反应式为![]()
D.充电时,当电路中通过![]() 电子的电量时,A、B两极质量变化差为
电子的电量时,A、B两极质量变化差为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.红褐色固体![]() 全部溶于氢碘酸:
全部溶于氢碘酸:![]()
B.水杨酸溶于![]() 溶液中:
溶液中:![]()
C.将等浓度的![]() 溶液与
溶液与![]() 液按体积比2:3混合:
液按体积比2:3混合:![]()
D.洁厕灵(含![]() )与84消毒液混合后产生氯气:
)与84消毒液混合后产生氯气:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氧有机化合物是重要的化学工业原料。完成下列填空:
(1)工业上,乙醇可以通过粮食发酵制取,也可由乙烯在一定条件下和__________反应制取。
(2)乙醇催化氧化生成乙醛,将铜丝在空气中灼烧变黑后,迅速伸入乙醇中,观察到铜丝表面________________;反复上述多次操作后,闻到刺激性气味,说明有_____________生成。
(3)乙醛中的官能团为____________。乙醛与环氧乙烷(![]() )互为____________。
)互为____________。
(4)写出检验乙醛的化学反应方程式:_______________________________________,上述反应显示乙醛具有__________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图:

下列说法中错误的是( )
A.过程①→②是吸热反应
B.Ni是该反应的催化剂
C.过程①→②既有碳氧键的断裂,又有碳氧键的形成
D.反应的总化学方程式可表示为:CH4+CO2![]() 2CO+2H2
2CO+2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时的电离平衡曲线如图所示:
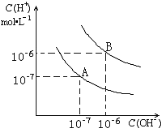
(1)25 ℃时水的电离平衡曲线应为__________ (填“A”或“B”)。
(2)95 ℃时水的离子积Kw=__________,c(H+)=__________
(3)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____。
(4)95 ℃时,若100 mL pH1=a的某强酸溶液与1 mL pH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com