
【题目】食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知:CH3COOH、H2CO3、HNO2的电离常数(25℃)分别为Ka=1.8×10-5;Ka1=4.3×10-7、Ka2=5.6×10-11;Ka=5.0×10-4请回答下列问题:
⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号。)
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变
⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中:
c(CH3COO-)/c(CH3COOH)=____
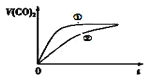
⑶常温下,将20mL 0.1mol/L CH3COOH溶液 和20mL 0.1mol/LHNO2 溶液分别与 20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,则表示CH3COOH溶液的曲线是_______(填写序号);
⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示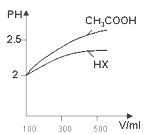 ,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =___________
【答案】ad 18 ② 小于 1.8×10-5
【解析】
(1)一定温度下,CH3COONa抑制 CH3COOH 电离;Kw=c(OH-)·c(H+),水的离子积常数只与温度有关;
(2)根据醋酸的电离平衡常数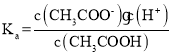 分析c(CH3COO-)/c(CH3COOH)的值;
分析c(CH3COO-)/c(CH3COOH)的值;
(3)氢离子浓度越大,反应速率越快;
(4)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的酸性强,变化小的酸性弱;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,恰好完全反应生成氯化铵,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等。
(1)a.向0.1mol/L CH3COOH 溶液中加入少量CH3COONa 晶体,醋酸根离子浓度增大,醋酸电离平衡逆向移动,氢离子浓度减小,溶液的pH增大,故a正确;
b.CH3COONa抑制 CH3COOH 电离,加入醋酸钠晶体,CH3COOH的电离程度减小,故b错误;
c.CH3COONa是强电解质,加入CH3COONa,离子浓度增大,溶液的导电能力增强,故c错误;
d.Kw=c(OH-)·c(H+),水的离子积常数只与温度有关,温度不变,则溶液中c(OH-)·c(H+)不变,故d正确;
故选ad;
(2)醋酸的电离平衡常数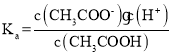 =1.8×10-5,所得混合液的pH=6,说明c(H+)=10-6,所以c(CH3COO-)/c(CH3COOH)=18;
=1.8×10-5,所得混合液的pH=6,说明c(H+)=10-6,所以c(CH3COO-)/c(CH3COOH)=18;
(3)氢离子浓度越大,反应速率越快,CH3COOH的电离常数小于HNO2,同浓度的CH3COOH和 HNO2,HNO2溶液中氢离子浓度大于CH3COOH,所以曲线②表示CH3COOH溶液;
(4)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的为强酸,小的为弱酸,所以HX的酸性小于醋酸,则HX的电离平衡常数小于醋酸;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,恰好完全反应生成氯化铵,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相等,则醋酸和一水合氨电离程度相等,其电离平衡常数相等,即NH3·H2O的电离常数Kb=1.8×10-5mol/L。


科目:高中化学 来源: 题型:
【题目】石油是工业的血液,与我们的生产、生活息息相关。
(1)乙烯是石油化工重要的基础原料。 写出乙烯的电子式____________
(2)分子式为C5H12的某烃,分子中含有4个甲基,该烃的结构简式为_______________________。
(3)与乙烯互为同系物的是_______ 。(选填编号)
a. CH3CH=CH2 b. CH2=CHCH=CH2
c. CH≡CH d. CH3CH3
(4)聚乙烯安全无毒,可用于制食品包装袋。聚乙烯的结构简式为 ________________ 。
(5)乙炔三聚可得到苯或二乙烯基乙炔 (CH2=CH-C-C-CH=CH2) 。鉴别苯和二乙烯基乙炔可用的试剂是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法不正确的是( )

A. 反应②比①要容易发生是因为反应②活化能大
B. 反应①和②均为放热反应
C. H2(g)+2ICl(g)= I2(g)+2HCl(g) H= -218 kJ·molˉ1
D. 反应①和②均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
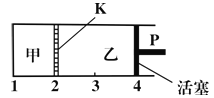
A.升高温度,达到新平衡后,甲中B的体积分数增大,乙中B的体积分数减小
B.将活塞由“4”推进到“3”,达到新平衡后,甲、乙两容器中C的百分含量相同
C.保持温度不变,向甲中再加入1mol A和2mol B,达到新平衡后,c(B)甲>2c(B)乙
D.保持温度和乙中压强不变,向乙中再加入2mol D,达到新平衡后,c(B)乙≤2c(B)甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入400 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。
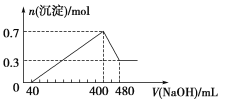
计算:
(1)合金中Mg的质量为________g;
(2)硫酸的物质的量浓度为________ mol·L1;
(3)NaOH溶液的物质的量浓度为________ mol·L1;
(4)生成H2在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1,则氢气的燃烧热为241.8kJ·mol-1
B.反应SO2(g)+2H2S(g)![]() 3S(s)+2H2O(l)在常温下能自发进行,则该反应的ΔH<0
3S(s)+2H2O(l)在常温下能自发进行,则该反应的ΔH<0
C.已知2C(s)+2O2(g)=2CO2(g) ΔH=a、 2C(s)+O2(g)=2CO(g) ΔH=b,则a>b
D.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,2.24LCCl4中含有分子数目为0.1NA
B.0. 1molFe粉与稀HNO3反应,转移电子数目为0.3NA
C.9.2gNO2和N2O4的混合气体中含有原子数目为0.6NA
D.pH = 13的Ba(OH)2溶液中含有OH-数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方法中不正确的是
A.少量的钠保存在煤油中B.新制的氯水保存在棕色试剂瓶中
C.保存硫酸亚铁溶液时需加少量铁粉D.NaOH溶液保存在带玻塞的细口试剂瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com