
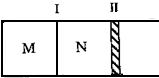
 如图所示,隔板I固定不动,活塞II可自由移动.M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g);△H<0.若起始时,M、N容积相同.下列说法正确的是( )
如图所示,隔板I固定不动,活塞II可自由移动.M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g);△H<0.若起始时,M、N容积相同.下列说法正确的是( )| A、起始时,分别向M、N两个容器中加入1molA、1molB,达平衡时,容器M、N中物质A的体积分数相同 |
| B、起始时,分别向M、N两个容器中加入1molA、3molB,达平衡时,容器M中物质A的转化率较大 |
| C、起始时,分别向M、N两个容器中加入2molC,容器N达到平衡所需的时间较短 |
| D、起始时,分别向M、N两个容器中加入1molA、3molB,达到平衡时,容器M中气体的密度较小 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
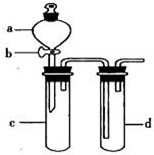 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuS的溶解度大于PbS的溶解度 |
| B、原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++ZnS→CuS+Zn2+ |
| D、整个过程涉及的反应类型只有氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁四种物质转化关系如图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.
甲、乙、丙、丁四种物质转化关系如图.已知甲是一种导致钢铁生锈及许多还原性物质变质的单质,化合物乙、丙、丁均含有第三周期一种相同元素R.| 温度/℃ | 400 | 450 | 500 | 550 | 600 | 650 |
| 转化率/% | 99.2 | 97.5 | 93.5 | 85.6 | 73.7 | 58.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaBH4既是氧化剂又是还原剂 |
| B、NaBH4是氧化剂,H2O是还原剂 |
| C、硼元素被氧化,氢元素被还原 |
| D、被氧化的元素与被还原的元素质量比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com