

| ①R′MgBr(足量) |
| ②H+/H2O |

 ,C发生消去反应生成D为
,C发生消去反应生成D为 ,D水解反应得到E为
,D水解反应得到E为 ,E与乙醇发生酯化反应生成F为
,E与乙醇发生酯化反应生成F为 ,F发生信息反应生成G,结合F与G的结合可知Y为CH3MgBr,据此解答.
,F发生信息反应生成G,结合F与G的结合可知Y为CH3MgBr,据此解答. ,C发生消去反应生成D为
,C发生消去反应生成D为 ,D水解反应得到E为
,D水解反应得到E为 ,E与乙醇发生酯化反应生成F为
,E与乙醇发生酯化反应生成F为 ,F发生信息反应生成G,结合F与G的结合可知Y为CH3MgBr,
,F发生信息反应生成G,结合F与G的结合可知Y为CH3MgBr,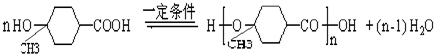 ,
, ,
,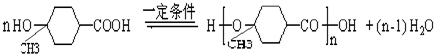 ;
; ;
;

科目:高中化学 来源: 题型:
| A、FeO固体放入稀硝酸溶液中:FeO+2H+═Fe2++H2O |
| B、过量的铁粉与稀硝酸溶液反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| C、向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
| D、向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com