
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |

| 10-14 |
| 10-4 |
| 2.6×10-39 |
| (10-10)3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| AgCl | Ag2CrO4 | AgBr | AgI | Ag2S | |
| K sp | 2×10-10 | 2×10-12 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 |
| 颜色 | 白色 | 砖红色 | 淡黄色 | 黄色 | 黑色 |
| A、K2CrO4 |
| B、KBr |
| C、KI |
| D、K2S |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ①R′MgBr(足量) |
| ②H+/H2O |

查看答案和解析>>
科目:高中化学 来源: 题型:
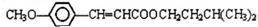 .合成路线如下:
.合成路线如下: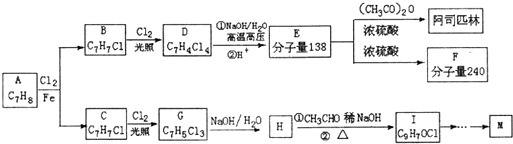
| 稀NaOH |
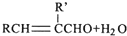
| △ |
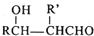
| 高温高压 |
| HBr |
| NaOH |
| 水/△ |
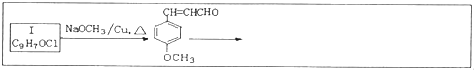
查看答案和解析>>
科目:高中化学 来源: 题型:
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验操作 | 实验现象 |
| Ⅰ | 将一束光亮洁净的铁丝伸入AgNO3溶液中,一段时间后,过滤. | 铁丝表面有银白色固体析出,溶液逐渐变为浅绿色 |
| Ⅱ | 取少量滤液,滴加几滴稀盐酸 | 有白色沉淀生成 |
| Ⅲ | 另取少量滤液,滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| IV | 另取少量滤液,滴入KSCN溶液,振荡 | 溶液不变红,出现白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com