
����Ŀ����֪ˮ��25���95��ʱ�������ƽ��������ͼ��ʾ��

��1����95��ʱ��ˮ�ĵ���ƽ������ӦΪB����˵������______________________��
25��ʱ����pH=9��NaOH��Һ��pH=4��������Һ��ϣ����û����Һ��pH=7����NaOH��Һ��������Һ�������Ϊ______________��
��2��95��ʱ����100���pH=a��ijǿ����Һ��1���pH=b��ijǿ����Һ��Ϻ���Һ�����ԣ���a��b֮��Ӧ����Ĺ�ϵ��______________��
��3������A����Ӧ���¶��£�pH=2��HCl��Һ��pH=11��ijBOH��Һ�У���ˮ�ĵ���̶ȷֱ�����1����2��ʾ������1______________��2(��������������С��������������������ȷ����)��
��4������B��Ӧ�¶��£���0.02mol/LBa(OH)2��Һ������ʵ���Ũ����NaHSO4��Һ�������Ϻ����Һ��pH=________________��
���𰸡���1��ˮ�ĵ��������ȹ��̣��¶ȸ�ʱ������̶ȴ�c��H+����c��OH-����10��1��
��2��a+b=14����3��С�ڣ���4��10
��������
�����������1��ˮ�ĵ��������ȹ��̣��¶ȸ�ʱ������̶ȴ�c��H+����c��OH-��������95��ʱ��ˮ�ĵ���ƽ������ӦΪB��25��ʱ�� pH��9��NaOH��Һ��c(OH-)=10-5mol/L��pH��4��H2SO4��Һ��ϣ�c(H+)=10-4mol/L�������û����Һ��pH��7��n(OH-)=n(H+)����c(OH-)V(NaOH)= c(H+)V(H2SO4)����NaOH��Һ��H2SO4��Һ�������ΪV(NaOH)��V(H2SO4)= c(H+)��c(OH-)=10:1��
��2��95��ʱ��ˮ�����ӻ�������Kw=10-12����100���pH��a��ijǿ����Һ��n(H+)=100��10-amol=10(2-a)mol��1���pH��b��ijǿ����Һn(OH-)=10-12��10-b=10(b-12)mol����Ϻ���Һ�����ԣ�10(2-a)mol=10(b-12)mol��2-a=b-12������a+b=14��
��3������A����Ӧ���¶������¡��������£�pH��2��HCl��Һ��c(H+)(ˮ)=10-12mol/L��pH��11��ijBOH��Һ�У�c(H+)(ˮ)=10-11mol/L��ˮ���������H+��Ũ��Խ��ˮ�ĵ���̶Ⱦ�Խ����ˮ�ĵ���̶ȷֱ��æ�1����2��ʾ�����1����2��
��4������B����Ӧ���¶���95 �棬���¶���ˮ�����ӻ�������Kw=10-12��������B����Ӧ���¶��£���0.02 mol/L��Ba(OH)2��Һ������ʵ���Ũ�ȵ�NaHSO4��Һ�������ϣ���Ӧ����Һ��c(OH-)=0.02mol��2L=0.01mol/L�����ڸ��¶���ˮ�����ӻ�������Kw=10-12������c(H+)=10-10�����û��Һ��pH��10��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼI ��NO2(g) +CO(g��![]() CO2(g)+NO(g)��Ӧ�����������仯��ʾ��ͼ��һ�������£��ڹ̶��ݻ����ܱ������и÷�Ӧ�ﵽƽ��״̬�����ı�����һ������X, Y��X�ı仯��ϵ������ͼII��ʾ��
CO2(g)+NO(g)��Ӧ�����������仯��ʾ��ͼ��һ�������£��ڹ̶��ݻ����ܱ������и÷�Ӧ�ﵽƽ��״̬�����ı�����һ������X, Y��X�ı仯��ϵ������ͼII��ʾ��

�����й�˵����ȷ���ǣ� ��
A��һ�������£����ܱ������м���1molNO2(g����1molCO(g����Ӧ�ų�234kJ����
B����X��ʾCO����ʼŨ�ȣ���Y��ʾ�Ŀ�����NO2��ת����
C����X��ʾ��Ӧʱ�䣬��Y��ʾ�Ŀ����ǻ��������ܶ�
D����X��ʾ�¶ȣ���Y��ʾ�Ŀ�����CO2�����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ã�����Һa�������b��, ���������в���ȷ���ǣ� ��
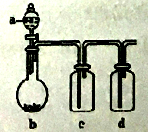
A����aΪŨ���ᣬbΪNa2SO3���壬c��ʢʯ����Һ����c����Һ�ȱ�����ɫ
B����aΪŨ���ᣬbΪMnO2��c��ʢƷ����Һ����c����Һ����ɫ
C����aΪ������Һ��bΪ���ǣ�c��ʢ��������ʯ��ˮ����c����Һ�����
D����aΪŨ��ˮ��bΪ��ʯ�ң�c��ʢAlCl3��Һ����c�в�����ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⻯��(NaBH4��Ϊ��ɫ��ĩ��������ˮ���⣬�����������(�۵㣺-101�����е㣺33�������ڸɿ������ȶ�����ʪ�����зֽ⣬�����ϳɺ��л��ϳ��г��õ�ѡ���Ի�ԭ����ij�о�С�����ƫ������(NaBO2��Ϊ��Ҫԭ���Ʊ�NaBH4�����������£�����˵������ȷ����( ��
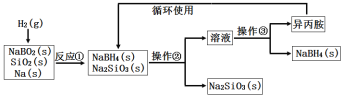
A��ʵ������ȡ����������Ҫ�õ���ʵ����Ʒ�����ӡ���ֽ������Ƭ��С��
B�����������������ֱ��ǹ����������ᾧ
C����Ӧ������֮ǰ�轫��Ӧ��������100�����ϲ�ͨ�����
D����Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���������������ԭ�����͵��ǣ� ��
A. ����ɫ��NO2����ѹ����ɫ�ȱ�����dz
B. ��ѹ�ȳ�ѹ�����ںϳ�SO3
C. ������������ڰ��ĺϳ�
D. ��ҵ��ȡ������Na(l)+KCl(l)![]() NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з������
NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹK��������ӷ�Ӧ������з������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. Fe��Mn��Zn��Mg
B. Zn��Cu��Mn��Ca
C. Zn��Cu��B��Mn
D. Mg��Mn��Cu��Mo
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���Һ�����Ӵ��ں�ת���ı����������( ��
A����0.1mol/L��pH=1��NaHA��Һ�м���NaOH��Һ��HA-+OH-=A2-+H2O
B����״���£���1.12LCO2����ͨ��1L0.1mol/L��NaAlO2��Һ�У�CO2��2H2O��AlO2��=Al(OH��3����HCO3-
C����ˮ�������c(H������1��10-12mol/L����Һ�п��ܴ�������K+��I-��Mg2+��NO3-
D����NH4Al(SO4��2��Һ�еμ�Ba(OH��2��ҺʹSO42-��ȫ������NH4����Al3����2SO42-��2Ba2+��4OH��=NH3��H2O��Al(OH��3����2BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ����
A. Ħ���ǹ��ʵ�λ���߸�����������֮һ
B. 1 L 0.1 mol/L BaCl2��Һ��������Cl��Ϊ0.1 NA
C. ���³�ѹ�£�11.2 L Cl2�����ķ�����Ϊ0.5 NA
D. ���³�ѹ�£�32 g O2���е���ԭ����Ϊ2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2.56gCu��һ������ŨHNO3��Ӧ������Cu�IJ��ϼ��٣���Ӧ�����������ɫ��dz����Cu ��Ӧ���ʱ�����ռ���������1.12L(��״��)����Ӧ������HNO3�����ʵ���Ϊ( )
A��0.05 mol B��1mol C��1.05mol D��0.13mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com