
【题目】硼氢化钠(NaBH4)为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干空气中稳定,在湿空气中分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:下列说法不正确的是( )
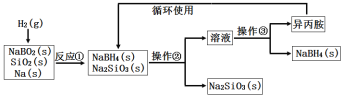
A.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀
B.操作②、操作③分别是过滤与蒸发结晶
C.反应①加料之前需将反应器加热至100℃以上并通入氩气
D.反应①中氧化剂与还原剂的物质的量之比为1∶2
【答案】B
【解析】
试题分析:A、由于钠的硬度较小,且保存在煤油中,所以取用少量钠需要用滤纸吸干煤油,再用镊子、小刀在玻璃片上切割,故A正确;B、根据上面的分析可知,操作②、操作③分别是过滤与蒸馏,故B错误;C、NaBH4常温下能与水反应,且氢气和氧气混合加热易产生爆炸现象,为防止NaBH4水解、防止产生安全事故,需要将装置中的空气和水蒸气排出,所以反应①加料之前需将反应器加热至100℃以上并通入氩气排尽装置中的空气和水蒸气,故C正确;D、反应①中发生的反应为NaBO2+2SiO2+4Na+2H2═NaBH4+2Na2SiO3,反应中氢气中氧化剂,钠是还原剂,所以氧化剂与还原剂的物质的量之比为1:2,故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】在100℃时,将0.40mol二氧化氮气体充入2L密闭容器中,每隔一段时间对该容器内的得到数据如下
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法中正确的是
A.反应开始20s内以二氧化氮表示的平均反应速率为0.00125mol·L-1·s-
B.80s时混合气体的颜色与60s时相同,比40s时的颜色深
C.80s时向容器中加入0.32mol氦气,同时将容器扩大为4L,则平衡将不移动
D.若起始投料为0.20molN2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)常温下0.1moL/L 盐酸和0.06mol/L氢氧化钡溶液以等体积混合后pH=______
(2)常温下pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4:1的体积比混合,则混合溶液的pH=_______(己知lg2=0.3,lg5=0.7)
(3)如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y, 起始时VA=VB=a L。在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y![]() 2Z+ W;正反应为放热反应,(四物质均为气体)。达到平衡时。VA=1.2aL,试回答:
2Z+ W;正反应为放热反应,(四物质均为气体)。达到平衡时。VA=1.2aL,试回答:
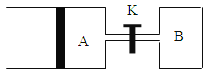
①A中的X的转化率 αA=__________;
②A、B中X的转化率αA ______αB (填“>、=、<”)
③打开K,一段时间后又达到平衡时,A 的体积为_______ L(连通管中的气体体积不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体。请回答下列问题:
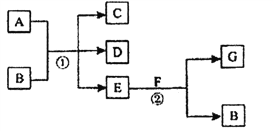
(1)A、G的化学式分别为_______________、________________。
(2)写出A与Fe反应的化学方程式___________________ 。
(3)写出反应②的化学方程式______________________。
(4)己知A是一种重要的化工原料,在工农业生产和生活中有着重要的应用。请根据所学知识回答下列问题。
①将A通入紫色石蕊试液中,观察到的现象是________________;请写出A与水反应的化学方程
式 。
②A与石灰乳反应制得的漂白粉的有效成分是_________(填化学式);该物质在空气中失效的原因______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列说法正确的是( )
A.洗涤剂除油污的原理与热碱液除油污的原理相同
B.食品包装内放置生石灰与放置硅胶的作用相同
C.聚乙烯和聚氯乙烯的单体相同
D.自来水中加入漂白粉与加入硫酸铝的作用相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+ N(g) ![]() E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2molL-1.下列说法正确的是( )
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2molL-1.下列说法正确的是( )
A.4min时,M的转化率为80%
B.4min时,用M表示的反应速率为0.8molL-1min-1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:

(1)则95℃时,水的电离平衡曲线应为B,请说明理由______________________.
25℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为______________。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是______________.
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______________α2(填“大于”、“小于”、“等于”或“无法确定”)。
(4)曲线B对应温度下,将0.02mol/LBa(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合后,混合溶液的pH=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从毒韭菜到炸鸡翅、从速溶茶到儿童奶粉,关于食品质量的报道中不断有①“致癌农药”、②“苏丹红”、③“碘元素”、④“亚硝酸盐”、⑤“三聚氰胺”等化学名词出现。业内人士告诉记者,化学性污染正成为危急食品安全的一大“杀手”。上述化学名词所提到的物质中,在某食品添加剂中允许含有但符合限量时不会引起中毒的是( )
A.②③④ B.②③ C.③④ D.只有③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①2H2(g)+O2(g)=2H2O(l)ΔH1=-571.6kJmol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0kJmol-1
③CO(g)+2H2(g)![]() CH3OH(g)ΔH3=-90.8kJmol-1
CH3OH(g)ΔH3=-90.8kJmol-1
计算甲醇蒸气的燃烧热ΔH= 。
(2)对于可逆反应C(S)+H2O(g)![]() CO(g)+H2(g),平衡常数表达式为 ,能判断该反应一定达到化学平衡状态的依据是 。(填选项编号)
CO(g)+H2(g),平衡常数表达式为 ,能判断该反应一定达到化学平衡状态的依据是 。(填选项编号)
A.容器中气体的平均相对分子质量不随时间而变化
B.v正(H2O)=v逆(H2)
C.容器中气体的密度不随时间而变化
D.容器中总质量不随时间而变化
E.消耗n mol H2的同时消耗n mol CO
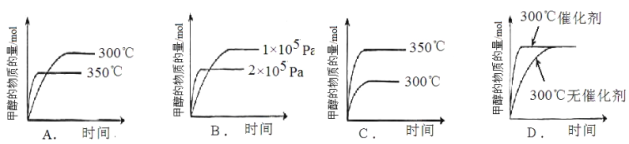
(3)某化学兴趣小组探究外界条件对合成甲醇反应的影响。
CO(g)+2H2(g)![]() CH3OH(g)△H=-91kJmol-1
CH3OH(g)△H=-91kJmol-1
①在300℃时,向体积为1L的密闭容器中加入2mol H2和1mol CO,CO和CH3OH(g)的浓度随时间变化如图所示。
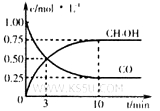
则从反应开始到建立平衡,v(H2)为 ;
②在其它条件不变时,只改变其中的一个条件,该小组同学根据实验绘制如下图像,其中与事实相符的是 。(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com