
【题目】在100℃时,将0.40mol二氧化氮气体充入2L密闭容器中,每隔一段时间对该容器内的得到数据如下
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法中正确的是
A.反应开始20s内以二氧化氮表示的平均反应速率为0.00125mol·L-1·s-
B.80s时混合气体的颜色与60s时相同,比40s时的颜色深
C.80s时向容器中加入0.32mol氦气,同时将容器扩大为4L,则平衡将不移动
D.若起始投料为0.20molN2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等
【答案】D
【解析】
试题分析:由表中数据,60s、80s是四氧化二氮的物质的量相等,则60s时到达平衡,由N元素守恒可知,n1=0.3,n2=0.07,n3=n4=0.24。A.v(NO2)=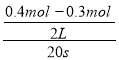 =0.0025mol/(Ls),故A错误;B、60s、80s时四氧化二氮的物质的量相等,则60s时到达平衡,由N元素守恒可知,n1=0.3,n2=0.07,n3=n4=0.24,2NO2N2O4,平衡状态NO2浓度为
=0.0025mol/(Ls),故A错误;B、60s、80s时四氧化二氮的物质的量相等,则60s时到达平衡,由N元素守恒可知,n1=0.3,n2=0.07,n3=n4=0.24,2NO2N2O4,平衡状态NO2浓度为![]() =0.12mol/L,N2O4平衡浓度=
=0.12mol/L,N2O4平衡浓度=![]() =0.04mol/L,平衡常数K=
=0.04mol/L,平衡常数K=![]() =2.78,0.30molNO2和0.10molN2O4,依据浓度商Q=
=2.78,0.30molNO2和0.10molN2O4,依据浓度商Q= =2.2<K=2.78,v正>v逆,故B错误;C.体积扩大反应混合物的浓度降低,平衡向气体体积增大的方向移动,即向生成二氧化氮的方向移动,故C错误;D.相同条件下,起始投料为0.20molNO2达到平衡与开始投入0.40molNO2到达的平衡状态相比,恒容容器中达到平衡,NO2的体积分数减小,故D正确,故选D。
=2.2<K=2.78,v正>v逆,故B错误;C.体积扩大反应混合物的浓度降低,平衡向气体体积增大的方向移动,即向生成二氧化氮的方向移动,故C错误;D.相同条件下,起始投料为0.20molNO2达到平衡与开始投入0.40molNO2到达的平衡状态相比,恒容容器中达到平衡,NO2的体积分数减小,故D正确,故选D。


科目:高中化学 来源: 题型:
【题目】在2L密闭容器中发生反应N2+3H22NH3,经一段时间后NH3的物质的量增加了2.4mol,这段时间内用氢气表示的反应速率为0.6mol/(L.s),则这段时间为( )
A.6s B.4s C.3s D.2s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:

已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3↑+ 8AlO2-
3NH3↑+ 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中可能存在Na+、Cl-
C.试样中一定不含Al3+
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于食品添加剂的叙述错误的是( )
A. 亚硝酸钠是一种致癌物质 B. 营养强化剂也是一种食品添加剂
C. 醋可同时用作调味剂和防腐剂 D. 胡萝卜素和柠檬黄是常见的着色剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的铜、铝混合物与一定体积硝酸溶液恰好完全反应,得硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与标准状况下3.36L氧气混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸盐溶液中加入NaOH溶液至沉淀最多停止加入,将所产生沉淀滤出,将滤液加水稀释至600ml,此时所得溶液的物质的量浓度为( )
A.1mol/L B.0.5mol/L C.1.2mol/L D.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图I 是NO2(g) +CO(g)![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X, Y随X的变化关系曲线如图II所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X, Y随X的变化关系曲线如图II所示。

下列有关说法正确的是( )
A.一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示反应时间,则Y表示的可能是混合气体的密度
D.若X表示温度,则Y表示的可能是CO2的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产生活中应用广泛,请解决下列问题。
(1)硫酸铜溶液时白磷引起中毒的一种解毒剂:
P4+CuSO4+H2O![]() Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 。
Cu3P+H3PO4+H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为 。
(2)氮的化合物合成、应用及氮的固定一直是科学研究的热点。以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(3)右图表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。
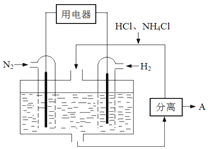
(4)常温下,向0.1mol/L氨水中加入少许N2O5,使溶液中c(NH3·H2O):c(NH4+)=5:9,此时溶液的pH= .(25℃时,NH3·H2O的电离常数Kb=1.8×10-5)
(5)SiO2溶于氢氟酸后生成一种极强的二元酸和水,经分析该酸由3种元素组成,其中氟元素的质量分数为79.17%。请写出SiO2溶于氢氟酸的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干空气中稳定,在湿空气中分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:下列说法不正确的是( )
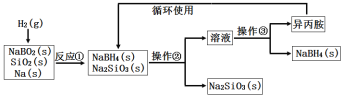
A.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀
B.操作②、操作③分别是过滤与蒸发结晶
C.反应①加料之前需将反应器加热至100℃以上并通入氩气
D.反应①中氧化剂与还原剂的物质的量之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com