


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
| A、原混合物中n(Fe):n(Fe2O3)=2:1 |
| B、向溶液中滴入KSCN溶液,显红色 |
| C、无法计算原混合物的质量a |
| D、此时溶液中Fe2+和Fe3+的物质的量之比为3:1 |
查看答案和解析>>
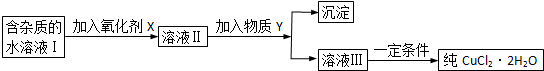
科目:高中化学 来源: 题型:
查看答案和解析>>
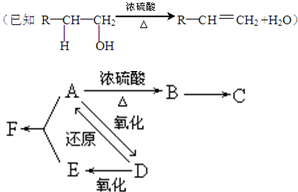
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、②③⑤ |
| C、②③ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2、2H、H+是三种不同的核素 |
| B、3He和4He互为同位素 |
| C、14C和14N互为同素异形体 |
| D、元素的种类多于核素的种类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4=2H++S6++4O2- |
| B、AlCl3=Al3++Cl3- |
| C、Ba(OH)2=Ba2++2OH- |
| D、Na2CO3=Na2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com