
【题目】下列反应属于吸热反应的是( )
A. 炭燃烧生成一氧化碳 B. 中和反应
C. Ba(OH)2·8H2O与NH4Cl反应 D. 锌粒与稀H2SO4反应制取H2
科目:高中化学 来源: 题型:
【题目】半导体工业用石英砂做原料通过三个重要反应生产单质硅: SiO2(s)(石英砂)+2C(s)═Si(s)(粗硅)+2CO(g),△H=682.44kJ/mol
Si(s)(粗硅)+2Cl2(s)═SiCl4(g),△H=﹣657.01kJ/mol
SiCl4(g)(纯硅)+2Mg(s)═2MgCl2(s)+Si(s),△H=﹣625.63kJ/mol
生产1.00kg纯硅的总反应热为( )
A.2.43×104kJ
B.﹣2.35×104kJ
C.﹣2.23×104kJ
D.﹣2.14×104kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键和共价键的断裂和形成的是
A. 2H2+O2![]() 2H2O B. NH3+HCl=NH4Cl
2H2O B. NH3+HCl=NH4Cl
C. 2Na2O2+2H2O=4NaOH+O2↑ D. 2Mg+CO2![]() 2MgO+C
2MgO+C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 向AgNO3溶液中滴加氨水至过量:Ag++NH3·H2O=AgOH↓+NH4+
B. 向海带灰浸出液中加入硫酸、双氧水;2I-+2H++H2O2=I2+2H2O
C. 向Na2S2O3溶液中加入足量稀硫酸;2S2O32-+4H+=SO42-+3S↓+2H2O
D. 向苯酚钠溶液中通入少量CO2气体:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +CO32-
+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在生产生活中应用十分广泛.请回答下列问题: 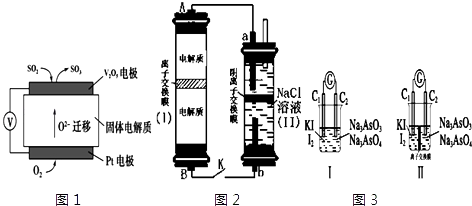
(1)通过SO2传感器可监测大气中SO2的含量,其工作原理如图1所示. ①固体电解质中O2﹣向极移动(填“正”或“负”).
②写出V2O5电极的电极反应式: .
(2)如图2所示装置I是一种可充电电池,装置Ⅱ是一种以石墨为电极的家用环保型消毒液发生器.装置I中离子交换膜只允许Na+通过,充放电的化学方程式为:2Na2S2+NaBr3 ![]() Na2S4+3NaBr ①负极区电解质为:(用化学式表示)
Na2S4+3NaBr ①负极区电解质为:(用化学式表示)
②家用环保型消毒液发生器发生反应的离子方程为 .
③闭合开关K,当有0.04mol Na+通过离子交换膜时,a电极上析出的气体在标准状况下体积为mL.
(3)如图3Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43﹣+2I﹣+2H+AsO33﹣+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40%NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量浓盐酸或适量40%NaOH溶液,发现电流表指针都发生偏转. ①甲组电流表指针都不发生偏转的原因是 .
②乙组添加的是(填“阴”或“阳”)离子交换膜.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题. 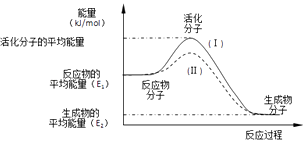
(1)图中所示的反应是(填“吸热”或“放热”)反应,该反应的△H=kJ/mol(用含E1、E2的代数式表示).
(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能明显降低,活化分子百分数增多,反应速率加快,你认为最有可能的原因是 .
(3)0.01mol甲苯(分子式为C7H8 , 常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出39.43kJ的热量.该反应的热化学方程式为: .
(4)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为:C(s)+H2O(g)═CO(g)+H2(g);焓变为△H1 . 已知:①2H2(g)+O2(g)═2H2O(g);△H2=﹣483.6kJ/mol
②2C(s)+O2(g)═2CO(g);△H3=﹣221.0kJ/mol结合上述热化学方程式计算得出△H1=kJ/mol
(5)计算△H1时所用到的基本化学规律叫做定律.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,有以下能量转化图,下列说法不正确的是( )
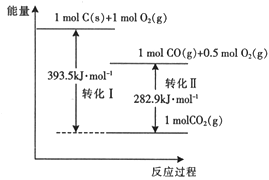
A. 转化Ⅱ的热化学方程式2CO(g)+O2(g)=2CO2(g) △H=-282.9 kJ·mol-1
B. 相同条件下,1mol C(s )和0.5 mol O2(g)总能量高于1mol CO(g)的能量
C. 由C→CO 的热化学方程式2C(s)+O2(g)=2CO(g) △H=-221.2 kJ·mol-1
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com