
【题目】国家卫生组织规定食盐必须是国家统一标准的加碘盐。加碘盐是指在食盐中加( )
A.I2B.NaIC.KID.KIO3
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】已知:R﹣CH=CH﹣O﹣R′ ![]() R﹣CH2CHO+R′OH(烃基烯基醚) 烃基烯基醚A的相对分子质量为176,分子中碳氢原子数目比为3:4.与A相关的反应如图:
R﹣CH2CHO+R′OH(烃基烯基醚) 烃基烯基醚A的相对分子质量为176,分子中碳氢原子数目比为3:4.与A相关的反应如图: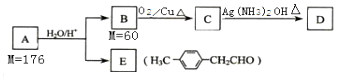
请回答下列问题:
(1)A的分子式为 , B的名称是 .
(2)写出C→D反应的化学方程式: .
(3)链烃M的相对分子质量比B多24,分子中所有碳原子均在同一平面上,其结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)在一定温度下,容器内某一反应中M,N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( ) 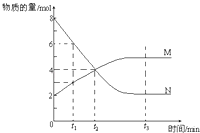
A.反应的化学方程式为:2 NM
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(molL﹣1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是( )
A.CH3OH的起始浓度为1.04mol/L
B.此时逆反应速率大于正反应速率
C.平衡时CH3OH的浓度为0.04mol/L
D.平衡时CH3OH的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述正确的是
A. 平衡后升高温度,混合气体中NO含量增大
B. 平衡后降低压强,混合气体平均摩尔质量增大
C. 4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
D. 平衡时,将水蒸气移除部分,此时逆反应速率降低,正反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a KJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b KJ·mol-1 (b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中转移电子的物质的量为_____mol,放出的热量为_________ kJ(用含有a和b的代数式表示)。
(2)己知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H=-870.3kJ/mo1
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mo1
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mo1
请写出H2燃烧热的热化学方程式______________________________________。
(3)在101kPa下,CH4(g)、H2(g)、C(s) 的燃烧热分别为890.3kJ/mol、285.8kJ/mol 和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3Mg (OH)25H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下方案: 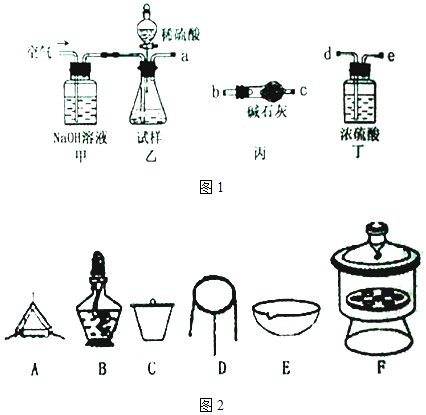
方案I 取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度
(1)乙中发生反应的方程式为 .
(2)仪器接口的连接顺序为(装置如图1可以重复使用)a , 丁的作用是 .
(3)当样品充分反应完后,缓慢通入空气的目的是 .
(4)方案 II①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g 下列仪器如图2中,该方案不会用到的是 .
(5)判断样品完全分解的方法是;本实验至少需要称量次.
(6)有同学认为方案 II高温煅烧的过程中会发生4MgCO3+SiO2 ![]() MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点正确吗?(填“正确”或“错误”)请说明理由: .
MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点正确吗?(填“正确”或“错误”)请说明理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行SO2的性质实验。在点滴板a、b、c处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如下表所示。( )
序号 | 试剂 | 实验现象 |
|
a | 品红溶液 | 红色褪去 | |
b | 酸性KMnO4溶液 | 紫色褪去 | |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
下列说法正确的是
A.浓硫酸与Na2SO3固体发生了氧化还原反应
B.a、b均表明SO2具有漂白性
C.c中只可能发生反应:SO2+ 2OH—= SO32-+ H2O
D.c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+) = 2c(SO32-) +c(HSO3) + c(OH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com