
ЎѕМвДїЎїДі»ЇС§РЎЧйТФ±ЅјЧЛбОЄФБПЈ¬ЦЖИЎ±ЅјЧЛбјЧхҐЈ¬ТСЦЄУР№ШОпЦКµД·РµгИзПВ±нЈє
ОпЦК | јЧґј | ±ЅјЧЛб | ±ЅјЧЛбјЧхҐ | |
·Рµг/Ўж | 64.7 | 249 | 199.6 | |
ГЬ¶И/g.cm-3 | 0.792 | 1.2659 | 1.0888 | |
ўс.єПіЙ±ЅјЧЛбјЧхҐґЦІъЖ·
ФЪФІµЧЙХЖїЦРјУИл12.2 g±ЅјЧЛбєН20 mLјЧґј(ГЬ¶ИФјОЄ0.79 gЎ¤cmЈ3)Ј¬ФЩРЎРДјУИл3 mLЕЁБтЛбЈ¬»мФИєуЈ¬Н¶ИлјёїйЛйґЙЖ¬Ј¬РЎРДјУИИК№·ґУ¦НкИ«Ј¬µГ±ЅјЧЛбјЧхҐґЦІъЖ·ЎЈ
ЈЁ1Ј©ЕЁБтЛбµДЧчУГКЗ______________Ј»Иф·ґУ¦ІъОпЛ®·ЦЧУЦРУРН¬О»ЛШ18OЈ¬РґіцДЬ±нКѕ·ґУ¦З°єу18OО»ЦГµД»ЇС§·ЅіМКЅЈє_________________________________________ЎЈ
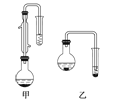
ЈЁ2Ј©јЧєНТТБЅО»Н¬С§·Ц±рЙијЖБЛИзНјЛщКѕµДБЅМЧКµСйКТєПіЙ±ЅјЧЛбјЧхҐµДЧ°ЦГ(јРіЦТЗЖчєНјУИИТЗЖчѕщТСВФИҐ)ЎЈёщѕЭУР»ъОпµД·РµгЈ¬ЧоєГІЙУГ__________Ч°ЦГ(МоЎ°јЧЎ±»тЎ°ТТЎ±)
ЈЁ3Ј©·ґУ¦ОпCH3OHУ¦№эБїЈ¬АнУЙКЗ__________________________ЎЈ
ўт.ґЦІъЖ·µДѕ«ЦЖ
ЈЁ4Ј©±ЅјЧЛбјЧхҐґЦІъЖ·ЦРНщНщє¬УРЙЩБїјЧґјЎў±ЅјЧЛбєНЛ®µИЈ¬ПЦДвУГПВБРБчіМНјЅшРРѕ«ЦЖЈ¬ЗлФЪБчіМНјЦР·ЅАЁєЕДЪМоИлІЩЧч·Ѕ·ЁµДГыіЖЎЈ

ЈЁ5Ј©НЁ№эјЖЛгЈ¬±ЅјЧЛбјЧхҐµДІъВКОЄ__________ЎЈ
Ўѕґр°ёЎїЈЁ1Ј©ґЯ»ЇјБЎўОьЛ®јБ ![]() +CH3OH
+CH3OH![]()
![]()
ЈЁ2Ј©јЧ ЈЁ3Ј©·ґУ¦ОпCH3OH№эБїЈ¬К№ЖЅєвПтУТТЖ¶ЇЈ¬УРАыУЪМбёЯ±ЅјЧЛбµДЧЄ»ЇВК
ЈЁ4Ј©·ЦТєЈ»ХфБу ЈЁ5Ј© 65.0%
ЎѕЅвОцЎї
КФМв·ЦОцЈєЈЁ1Ј©хҐ»Ї·ґУ¦ЦРЈ¬ЕЁБтЛбµДЧчУГКЗґЯ»ЇјБЎўОьЛ®јБЈ»хҐ»Ї·ґУ¦»ъАнКЗЛбНСфЗ»щґјНСЗвЈ¬ЛщТФ»ЇС§·ЅіМКЅОЄЈє![]() +CH3OH
+CH3OH![]()
![]() ЎЈ
ЎЈ
ЈЁ2Ј©УЙБЅЧ°ЦГНјїЙЦЄЈ¬јЧНјУРАдДэ№ЬЈ¬ід·ЦЖрµЅ»ШБчЧчУГЈ¬ТТНјФтГ»УРЈ¬¶ш±ѕМвЦР·ґУ¦ОпјЧґј·РµгµНЈ¬±ЅјЧЛбЎў±ЅјЧЛбјЧхҐµД·РµгФ¶ёЯУЪјЧґјЈ¬ИфІЙУГТТНјЈ¬јЧґј±Ш¶Ё»бґуБї»У·ўЈ¬І»АыУЪєПіЙ·ґУ¦Ј¬ЛщТФёщѕЭУР»ъОпµД·РµгЈ¬ЧоєГІЙУГјЧЧ°ЦГЎЈ
ЈЁ3Ј©їЙДж·ґУ¦Ј¬ЅшРРІ»і№µЧЈ¬ФцґуТ»ЦЦ·ґУ¦ОпЈЁјЧґјЈ©ЕЁ¶ИЈ¬К№ЖЅєвУТТЖЈ¬УРАыУЪМбёЯБнТ»ЦЦ·ґУ¦ОпЈЁ±ЅјЧЛбЈ©µДЧЄ»ЇВКЈ¬ЛщТФ·ґУ¦ОпCH3OH№эБїµДАнУЙКЗ·ґУ¦ОпCH3OH№эБїЈ¬К№ЖЅєвПтУТТЖ¶ЇЈ¬УРАыУЪМбёЯ±ЅјЧЛбµДЧЄ»ЇВКЎЈ
ЈЁ4Ј©ѕ№эaІЅєуµГµЅЛ®ІгєНУНІгЈ¬ЛщТФaКЗ·ЦТєЈ»УР»ъІгУЦ·ЦАліцІ»Н¬µДУР»ъОпЈ¬ЛщТФbКЗ·ЦБуЈ»
ЈЁ5Ј©УЙЛщёшКэѕЭїЙЦЄјЧґј№эБїЈ¬°ґ±ЅјЧЛбµДБїјЖЛгЈ¬12.2gµД±ЅјЧЛбµДОпЦКµДБїКЗ0.1mol,АнВЫЙПУ¦µГ±ЅјЧЛбјЧхҐµДЦКБїКЗ13.6gЈ¬КµјКµГ8.84gЈ¬ЛщТФ±ЅјЧЛбјЧхҐµДІъВКОЄ8.84g/13.6gЎБ100%=65.0%ЎЈ


 РДЛгїЪЛгЗЙЛгТ»їОТ»Б·ПµБРґр°ё
РДЛгїЪЛгЗЙЛгТ»їОТ»Б·ПµБРґр°ё
| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДЬФґОКМвКЗИЛАаЙз»бГжБЩµДЦШґуїОМвЈ¬јЧґјКЗОґАґЦШТЄµДВМЙ«ДЬФґЦ®Т»ЎЈ
ЈЁ1Ј©АыУГ№¤Тµ·ПЖшCO2їЙЦЖИЎјЧґјЈ¬јєЦЄіЈОВіЈС№ПВПВБР·ґУ¦µДДЬБї№ШПµИзНјЈє

ФтCO2УлH2·ґУ¦ЙъіЙТєМ¬CH3OH µДИИ»ЇС§·ЅіМКЅОЄ_______________________ЎЈ
ЈЁ2Ј©CH4 єНH2O(g)НЁ№эПВБРЧЄ»ЇТІїЙТФЦЖµГCH3OH:
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g)Ј» ЎчH1>0
CO(g)+3H2(g)Ј» ЎчH1>0
II.CO(g)+2H2(g)![]() CH3OH(g)Ј» ЎчH2<0
CH3OH(g)Ј» ЎчH2<0
Ѕ«1.0molCH4 єН3.0molH2O (g)НЁИл·ґУ¦КТЈЁИЭ»эОЄ100LЈ©ЦРЈ¬ФЪТ»¶ЁМхјюПВ·ўЙъ·ґУ¦IЈ¬CH4µДЧЄ»ЇВКУлОВ¶ИЎўС№ЗїµД№ШПµИзПВНјЛщКѕЎЈ

ўЩ НјЦРµДP1___P2ЈЁМоЎ°<Ў±ЎўЎ°>Ў±»тЎ°=Ў±) Ј¬ЕР¶ПµДАнУЙКЗ________________ЎЈ
ўЪ Иф·ґУ¦IIФЪєгИЭГЬ±ХИЭЖчЅшРРЈ¬ПВБРДЬЕР¶П·ґУ¦IIґпµЅЖЅєвЧґМ¬µДКЗ______ЈЁМоРтєЕЈ©ЎЈ
AЈ®ЙъіЙCH3OH µДЛЩВКУлПыєДCO µДЛЩВКПаµИ BЈ®»мєПЖшМеµДГЬ¶ИІ»±д
CЈ®»мєПЖшМеµДЧЬОпЦКµДБїІ»±д DЈ®CH3OHЎўCOЎўH2µДЕЁ¶И¶јІ»ФЩ·ўЙъ±д»Ї
ўЫФЪДіОВ¶ИПВЈ¬Ѕ«Т»¶ЁБїµДCOєНH2Н¶Ил10LµДГЬ±ХИЭЖчЦР·ўЙъ·ґУ¦IIЈ¬5minК±ґпµЅЖЅєвЈ¬ёчОпЦКµДОпЦКµДЕЁ¶ИЈЁmolЎ¤ L-1Ј©±д»ЇИзПВ±нЛщКѕЈє
2min | 5min | 10min | |
CO | 0.07 | 0.06 | 0.05 |
H2 | 0.14 | 0.12 | 0.20 |
CH3OH | 0.03 | 0.04 | 0.05 |
Иф5minК±Ц»ёД±дБЛДіТ»МхјюЈ¬ФтЛщёД±дµДМхјюКЗ_______________ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїФЛУГ»ЇС§·ґУ¦ФАнСРѕїМјЎўµЄµДµҐЦКј°Жд»ЇєПОпµД·ґУ¦¶Ф»єЅв»·ѕіОЫИѕЎўДЬФґОЈ»ъѕЯУРЦШТЄТвТеЎЈ
ЈЁ1Ј©јЧґјЧчОЄТ»ЦЦЦШТЄµД»Ї№¤ФБПЈ¬јИїЙТФЧчОЄИјБПЈ¬»№їЙУГУЪєПіЙЖдЛь»Ї№¤ФБПЎЈФЪТ»¶ЁМхјюПВїЙАыУГјЧґјфК»щ»Ї·ЁЦЖИЎјЧЛбјЧхҐЈ¬Жд·ґУ¦ФАнїЙ±нКѕОЄЈєCH3OH(g)Ј«CO(g)![]() HCOOCH3(g) ЎчHЈЅЈ29.1kJ/molЎЈПтМе»эОЄ2 LµДГЬ±ХИЭЖчЦРідИл2mol CH3OH(g)єН2molCOЈ¬ІвµГИЭЖчДЪµДС№Зї(pЈєkPa)ЛжК±јд(min)µД±д»Ї№ШПµИзПВНјЦРўсЎўўтЎўўуЗъПЯЛщКѕЈє
HCOOCH3(g) ЎчHЈЅЈ29.1kJ/molЎЈПтМе»эОЄ2 LµДГЬ±ХИЭЖчЦРідИл2mol CH3OH(g)єН2molCOЈ¬ІвµГИЭЖчДЪµДС№Зї(pЈєkPa)ЛжК±јд(min)µД±д»Ї№ШПµИзПВНјЦРўсЎўўтЎўўуЗъПЯЛщКѕЈє

ўЩўтєНўсПа±ИЈ¬ёД±дµД·ґУ¦МхјюКЗ ЎЈ
ўЪ·ґУ¦ўсФЪ5 minК±ґпµЅЖЅєвЈ¬ФЪґЛМхјюПВґУ·ґУ¦їЄКјµЅґпµЅЖЅєвК±v(HCOOCH3)ЈЅ ЎЈ
ўЫ·ґУ¦ўтФЪ2 minК±ґпµЅЖЅєвЈ¬ЖЅєвіЈКэK(ўт)ЈЅ ЎЈФЪМе»эєНОВ¶ИІ»±дµДМхјюПВЈ¬ФЪЙПКц·ґУ¦ґпµЅЖЅєвўтК±Ј¬ФЩНщИЭЖчЦРјУИл1 mol COєН2mol HCOOCH3єуv(Хэ)______ v(Дж)(МоЎ°ЈѕЎ±Ў°ЈјЎ±Ў°ЈЅЎ±)Ј¬ФТтКЗ________________ЎЈ
ўЬ±ИЅП·ґУ¦ўсµДОВ¶И(T1)єН·ґУ¦ўуµДОВ¶И(T3)µДёЯµНЈєT1 T3(МоЎ°ЈѕЎ±Ў°ЈјЎ±Ў°ЈЅЎ±)Ј¬ЕР¶ПµДАнУЙКЗ_____________________________ЎЈ
ЈЁ2Ј©і¬ТфЛЩ·Й»ъФЪЖЅБчІг·ЙРРК±Ј¬ОІЖшЦРµДNO»бЖЖ»µіфСхІгЎЈїЖС§јТХэФЪСРѕїАыУГґЯ»ЇјјКхЅ«ОІЖшЦРµДNOєНCOЧЄ±діЙCO2єНN2ЎЈДіСРѕїРЎЧйФЪКµСйКТУГДіРВРНґЯ»ЇјБ¶ФCOЎўNOґЯ»ЇЧЄ»ЇЅшРРСРѕїЈ¬ІвµГNOЧЄ»ЇОЄN2µДЧЄ»ЇВКЛжОВ¶ИЎўCO»мґжБїµД±д»ЇЗйїцИзПВНјЛщКѕЈ¬АыУГТФПВ·ґУ¦МоїХЈєNOЈ«CO![]() N2Ј«CO2ЈЁУРCOЈ© 2NO
N2Ј«CO2ЈЁУРCOЈ© 2NO![]() N2Ј«O2ЈЁОЮCOЈ©
N2Ј«O2ЈЁОЮCOЈ©

ўЩИфІ»К№УГCOЈ¬ОВ¶Иі¬№э775 ЎжЈ¬·ўПЦNOµД·ЦЅвВКЅµµНЈ¬ЖдїЙДЬµДФТтОЄ Ј»
ўЪФЪn(NO)/n(CO)ЈЅ1µДМхјюПВЈ¬У¦їШЦЖЧојСОВ¶ИФЪ ЧуУТЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїУР»ъОпµДЅб№№їЙУГЎ°јьПЯКЅЎ±јт»Ї±нКѕЎЈCH3-CH=CH-CH3їЙјтРґОЄ![]() ЎЈУР»ъОпXµДјьПЯКЅОЄ
ЎЈУР»ъОпXµДјьПЯКЅОЄ
ЈЁ1Ј©УР»ъОпYКЗXµДН¬·ЦТм№№МеЈ¬ЗТКфУЪ·јПгМюЈ¬ YФЪТ»¶ЁМхјюДЬ·ўЙъѕЫєП·ґУ¦Ј¬РґіцЖд»ЇС§·ЅіМКЅ____________________________________________ ЎЈ
ЈЁ2Ј©XУлЧгБїµДH2ФЪТ»¶ЁМхјюПВ·ґУ¦їЙЙъіЙ»·ЧґµД±ҐєНМюZЈ¬ZµДТ»ВИґъОпУР___________ ЦЦЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїОпЦКЈЁt-BuNOЈ©2ФЪХэёэНй»тCCl4ЦРѕщїЙТФ·ўЙъ·ґУ¦ЈєЈЁt-BuNOЈ©2![]() 2ЈЁt-BuNOЈ©ЎЈФЪ20ЎжК±Ј¬Пт2LХэёэНйЦРјУИлЈЁt-BuNOЈ©2 1Ј®00 molЈ¬10 minК±·ґУ¦ґпЖЅєвЈ¬ґЛК±ЈЁt-BuNOЈ©2µДЖЅєвЧЄ»ЇВКОЄ65%ЈЁјЩЙи·ґУ¦№эіМЦРИЬТєМе»эКјЦХ±ЈіЦІ»±дЈ©ЎЈПВБРЛµ·ЁХэИ·µДКЗЈЁ Ј©
2ЈЁt-BuNOЈ©ЎЈФЪ20ЎжК±Ј¬Пт2LХэёэНйЦРјУИлЈЁt-BuNOЈ©2 1Ј®00 molЈ¬10 minК±·ґУ¦ґпЖЅєвЈ¬ґЛК±ЈЁt-BuNOЈ©2µДЖЅєвЧЄ»ЇВКОЄ65%ЈЁјЩЙи·ґУ¦№эіМЦРИЬТєМе»эКјЦХ±ЈіЦІ»±дЈ©ЎЈПВБРЛµ·ЁХэИ·µДКЗЈЁ Ј©
AЈ®·ґУ¦ФЪЗ°10 minДЪµДЖЅѕщЛЩВКОЄ¦НЈЁt-BuNOЈ©=0Ј®0325 molЎ¤LЈ1Ў¤minЈ1
BЈ®±ЈіЦЖдЛыМхјюІ»±дЈ¬ИфґЛК±ФЩПтИЬТєЦРјУИл1Ј®0 mol ЈЁt-BuNOЈ©2Ј¬ЦШРВґпЖЅєвК±ЈЁt-BuNOЈ©2
µДЧЄ»ЇВКФцґу
CЈ®±ЈіЦЖдЛыМхјюІ»±дЈ¬ИфёГ·ґУ¦ФЪCCl4ЦРЅшРРЈ¬ЖдЖЅєвіЈКэОЄ1Ј®9Ј¬ФтЈЁt-BuNOЈ©2µДЖЅєвЧЄ»ЇВКРЎУЪ65%
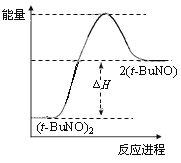
DЈ®±ЈіЦЖдЛыМхјюІ»±дЈ¬ЙэёЯОВ¶ИЈ¬ЈЁt-BuNOЈ©2µДЖЅєвЧЄ»ЇВКґуУЪ65%Ј¬ФтЖдДЬБї№ШПµїЙУГПВНј±нКѕЈє
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДїЗ°Ј¬»ШКХд嵥ЦКµД·Ѕ·ЁЦчТЄУРЛ®ХфЖшХфБу·ЁєНЭНИЎ·ЁµИЎЈДіРЛИ¤РЎЧйНЁ№эІйФДПа№ШЧКБПДвІЙУГИзПВ·Ѕ°ёґУё»ВнЛб·ПТєЈЁє¬де0.27%Ј©ЦР»ШКХТЧ»У·ўµДBr2Јє

ЈЁ1Ј©ІЩЧчXЛщРиТЄµДЦчТЄІЈБ§ТЗЖчОЄ Ј»ёГТЗЖчК№УГЗ°РлјмВ©Ј¬јмСй·Ѕ·ЁОЄ ЎЈ
ЈЁ2Ј©·ґЭНИЎК±јУИл20%µДNaOHИЬТєЈ¬ЖдАлЧУ·ЅіМКЅОЄ ЎЈ
ЈЁ3Ј©·ґЭНИЎЛщµГЛ®ПаЛб»ЇК±Ј¬Ри»єВэјУИлЕЁБтЛбЈ¬ІўІЙУГ±щЛ®ФЎАдИґµДФТтКЗ ЎЈ
ЈЁ4Ј©деµДґ«НіЙъІъБчіМОЄПИІЙУГВИЖшСх»ЇЈ¬ФЩУГїХЖшЛ®ХфЖшЅ«Br2ґµіцЈ»Улґ«Ні№¤ТХПа±ИЈ¬ЭНИЎ·ЁµДУЕµгКЗ ЎЈ
ЈЁ5Ј©ОТ№ъ·ПЛ®Иэј¶ЕЕ·Е±кЧј№ж¶ЁЈє·ПЛ®ЦР±Ѕ·УµДє¬БїІ»µГі¬№э1.00mgЎ¤LЁD1Ј¬КµСйКТїЙУГТ»¶ЁЕЁ¶ИµДдеЛ®Ів¶ЁДі·ПЛ®ЦР±Ѕ·УµДє¬БїЈ¬ЖдФАнИзПВЈє

ўЩЗлНкіЙПаУ¦µДКµСйІЅЦиЈє
ІЅЦи1ЈєЧјИ·БїИЎ25.00mLґэІв·ПЛ®УЪ250mLЧ¶РОЖїЦРЎЈ
ІЅЦи2ЈєЅ«4.5mL 0.02molЎ¤LЁD1деЛ®СёЛЩјУИлµЅЧ¶РОЖїЦРЈ¬ИыЅфЖїИыЈ¬ХсµґЎЈ
ІЅЦи3ЈєґтїЄЖїИыЈ¬ПтЧ¶РОЖїЦРјУИл№эБїµД0.1molЎ¤LЁD1 KIИЬТєЈ¬ХсµґЎЈ
ІЅЦи4Јє Ј¬ФЩУГ0.01molЎ¤LЁD1 Na2S2O3±кЧјИЬТєµО¶ЁЦБЦХµгЈ¬ПыєД Na2S2O3ИЬТє15mLЈЁ·ґУ¦ФАнЈєI2+2Na2S2O3=2NaI+Na2S4O6Ј©ЎЈ
ІЅЦи5ЈєЅ«КµСйІЅЦи1Ў«4ЦШёґ2ґОЎЈ
ўЪёГ·ПЛ®ЦР±Ѕ·УµДє¬БїОЄ mgЎ¤LЁD1ЎЈ
ўЫІЅЦи3ИфіЦРшК±јдЅПі¤Ј¬ФтІвµГµД·ПЛ®ЦР±Ѕ·УµДє¬Бї ЈЁМоЎ°Ж«ёЯЎ±ЎўЎ°Ж«µНЎ±»тЎ°ОЮУ°ПмЎ±Ј©ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїўсЎўµҐЦК№иУЙУЪЖдіЙКмµДЙъІъ№¤ТХ, ·бё»µДЙъІъФБПј°УЕТмµДРФДЬ±»№г·єУГУЪµзЧУРРТµј°М«СфДЬµзіШµДЙъІъµИ,ФЪ¶юСх»ЇМј·ХО§ЦРНЁ№эАыУГЅрКфДЖАґ»№Ф¶юСх»Ї№иїЙФЪЅПµНµДОВ¶ИМхјюПµõЅ№иЈ¬Н¬К±ЙъіЙТ»ЦЦСОXЈ¬ХвПа±ИЖрПЦУРµДЙъІъ№¤ТХѕЯУРЅЪФјДЬєДµДУЕКЖЎЈ
ЈЁ1Ј©РґіцЙПКцЦЖ±ё№иµД»ЇС§·ґУ¦·ЅіМКЅ_____________________ЎЈ
ЈЁ2Ј©¶юСх»Ї№иУл¶юСх»ЇМјОпАнРФЦКІо±рєЬґуЈ¬ФТтКЗ__________________________ЎЈ
ЈЁ3Ј©СОXµДИЬТєДЬУлAl2(SO4)3ИЬТє·ґУ¦ЙъіЙТ»ЦЦ°ЧЙ«іБµнєНЖшМеЎЈРґіцґЛ·ґУ¦µДАлЧУ·ґУ¦·ЅіМКЅ________ЎЈ
ўтЎўДіСОAУР3ЦЦФЄЛШЧйіЙЈ¬ТЧИЬУЪЛ®ЎЈЅ«AјУИИЈ¬ЙъіЙјИІ»ЦъИјЈ¬ТІІ»К№КЄИуµДємЙ«»тА¶Й«КЇИпКФЦЅ±дЙ«µДЖшМеBєНH2OЎЈЅ«AИЬУЪЛ®Ј¬ЅшРРПВБРКµСйЈєўЩЛбРФМхјюПВУлH2SЧчУГЙъіЙµ»ЖЙ«іБµнCЈ¬Н¬К±·ЕіцОЮЙ«ЖшМеDЈ¬DФЪїХЖшЦРЧЄ±дОЄємЧШЙ«ЖшМеEЈ»ўЪµ±НЁИлЧгБїCl2К±Ј¬ОЮГчПФПЦП󣬵«Ѕ«ЛщµГИЬТєЕЁЛхєујґїЙµГµЅОЮЙ«ѕ§МеСОFЎЈЗл»ШґрПВБРОКМвЈє
ЈЁ1Ј©РґіцAµД»ЇС§КЅЈє_____________Ј» BµДµзЧУКЅЈє_______________ЎЈ
ЈЁ2Ј©РґіцЙПКцКµСйўЩЎўўЪЛщ·ўЙъµДАлЧУ·ґУ¦·ЅіМКЅЈєўЩ________________________________Ј»ўЪ__________________________________ЎЈ
ЈЁ3Ј©DЎўE¶Ф»·ѕіУРОЈє¦Ј¬їЙУГNaOHИЬТєАґОьКХµИОпЦКµДБїµДDЎўE»мєПЖшМеЈ¬РґіцЖд»ЇС§·ґУ¦·ЅіМКЅ___________________ЎЈ
ЈЁ4Ј©ЕР¶ПСОFµДїЙДЬіЙ·Э______________Ј»ЙијЖКµСй·Ѕ°ёИ·¶ЁFµДіЙ·Э__________________ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЎѕ»ЇС§ЎЄСЎРЮ5:УР»ъ»ЇС§ЎїУР»ъОпAЎъFУРИзПВЧЄ»Ї№ШПµЈє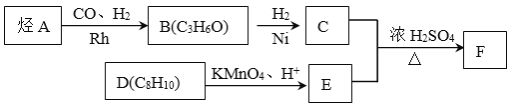
ТСЦЄЈєўЩ
ўЪєЛґЕ№ІХсЗвЖЧПФКѕCµД·ЦЧУЦРє¬УР4ЦЦІ»Н¬»ЇС§»·ѕіµДЗвФЧУЈ¬ЗТ·еГж»эЦ®±ИОЄ3:2:2:1ЎЈ
ўЫFКЗхҐАа»ЇєПОпЈ¬·ЦЧУЦР±Ѕ»·ЙПµДТ»деґъОпЦ»УРБЅЦЦЎЈ
ЈЁ1Ј©AµД·ЦЧУКЅКЗ Ј¬ЦчТЄУГНѕКЗ ЈЁРґТ»ЦЦЈ©ЎЈ
ЈЁ2Ј©јмСйBЦР№ЩДЬНЕµДіЈУГ·Ѕ·ЁКЗ ЎЈ
ЈЁ3Ј©DОпЦКµДГыіЖОЄ ЎЈ
ЈЁ4Ј©C+EЎъFµД»ЇС§·ЅіМКЅКЗ ЎЈ
ЈЁ5Ј©XУлE»ҐОЄН¬·ЦТм№№МеЈ¬ЗТXУРПВБРРФЦКЈ¬·ыєПМхјюµДXУР ЦЦЎЈ
ўЩЅУґҐNaHCO3УР¶юСх»ЇМјЖшМеІъЙъЎЈ
ўЪУлТш°±ИЬТє№ІИИУРТшѕµПЦПуЎЈ
ўЫ1Д¦¶ыXУлЧгБїДЖ·ґУ¦УР1Д¦¶ыЖшМеІъЙъЎЈ
ЈЁ6Ј©YУлEТІ»ҐОЄН¬·ЦТм№№МеЈ¬КфУЪхҐАа»ЇєПОпЈ¬·ЦЧУЦРЦ»є¬Т»ЦЦ№ЩДЬНЕЈ¬ЗТ±Ѕ»·ЙПµДТ»Пх»щИЎґъОпЦ»УРТ»ЦЦЈ¬ФтYµДЅб№№јтКЅОЄ ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїНј°Жд»ЇєПОпФЪ№¤Е©ТµЙъІъј°ИХіЈЙъ»оЦРУ¦УГ·ЗіЈ№г·є.
ЈЁ1Ј©ДЙГЧј¶Cu2OУЙУЪѕЯУРУЕБјµДґЯ»ЇРФДЬ¶шКЬµЅ№ШЧўЈ¬ПВ±нОЄЦЖИЎCu2OµДИэЦЦ·Ѕ·ЁЈє

ўЩ№¤ТµЙПіЈУГ·Ѕ·ЁўтєН·Ѕ·ЁўуЦЖИЎCu2O¶шєЬЙЩУГ·Ѕ·ЁIЈ¬ЖдФТтКЗ____________ЎЈ
ўЪТСЦЄЈє
2Cu(s)+1/2O2(g)ЁTCu2O(s)ЎчH=-169kJmol-1Ј¬
C(s)+1/2O2(g)ЁTCO(g)ЎчH=-110.5kJmol-1Ј¬
Cu(s)+1/2O2(g)ЁT2CuO(s)ЎчH=-157kJmol-1
Фт·Ѕ·ЁI·ўЙъµД·ґУ¦Јє2CuO(s)+C(s)=Cu20(s)+CO(g)Ј» ЎчH=____________kJ/molЎЈ
ЈЁ2Ј©Зв»ЇСЗНКЗТ»ЦЦємЙ«№ММеЈ¬їЙУЙПВБР·ґУ¦ЦЖ±ёЈє4CuSO4+3H3PO2+6H2O=4CuHЎэ+4H2SO4+3H3PO4Ј®
ёГ·ґУ¦ГїЧЄТЖ3molµзЧУЈ¬ЙъіЙCuHµДОпЦКµДБїОЄ____________ЎЈ
ЈЁ3Ј©ВИ»ЇНИЬТєЦРНёчОпЦЦµД·ЦІј·ЦКэ(ЖЅєвК±ДіОпЦЦµДЕЁ¶ИХјёчОпЦЦЕЁ¶ИЦ®єНµД·ЦКэ)Улc(Cl-)µД№ШПµИзНјЛщКѕЎЈ

ўЩµ±c(Cl-)=9molL-1К±Ј¬ИЬТєЦРЦчТЄµД3ЦЦє¬НОпЦЦЕЁ¶ИґуРЎ№ШПµОЄ____________ЎЈ
ўЪФЪc(Cl-)=1molL-1µДВИ»ЇНИЬТєЦРЈ¬µОИлAgNO3ИЬТєЈ¬є¬НОпЦЦјдЧЄ»ЇµДАлЧУ·ЅіМКЅОЄ____________(ИОРґТ»ёц)Ј®
ЈЁ4Ј©ТСЦЄЈєCu(OH)2КЗ¶юФЄИхјоЈ»СЗБЧЛб(H3PO3)КЗ¶юФЄИхЛбЈ¬УлNaOHИЬТє·ґУ¦Ј¬ЙъіЙNa2HPO3Ј®
ўЩФЪНСОИЬТєЦРCu2+·ўЙъЛ®Ѕв·ґУ¦µДЖЅєвіЈКэОЄ____________Ј¬(ТСЦЄЈє25ЎжК±Ј¬Ksp[Cu(OH)2]=2.0ЎБ10-20mol3L-3)
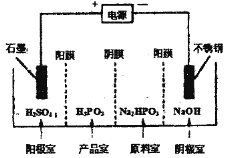
ўЪµзЅвNa2HPO3ИЬТєїЙµГµЅСЗБЧЛбЈ¬Ч°ЦГИзНј(ЛµГчЈєСфД¤Ц»ФКРнСфАлЧУНЁ№эЈ¬ТхД¤Ц»ФКРнТхАлЧУНЁ№э)Ј¬ФтІъЖ·КТЦР·ґУ¦µДАлЧУ·ЅіМКЅОЄ____________ЎЈ
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com