
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
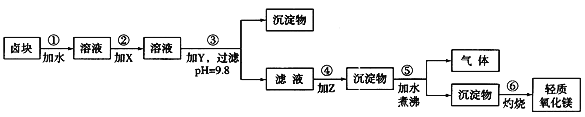
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6﹡ |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去
表2 原料价格表
物质 | 价格/(元·吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
(1)在步骤②中加入的试剂X,最佳的选择是____________,其作用是_________________;
(2)在步骤③中加入的试剂应是_______________________;之所以要控制pH=9.8,其目的是___________________________________________________________。
(3)在步骤④中加入的试剂Z应是________________;/p>
(4)在步骤⑤中发生反应的化学方程式是_____________________________________________。
【答案】漂液(或NaClO) 将Fe2+氧化为Fe3+ 烧碱(或NaOH) 使Fe3+、Mn2+沉淀完全,又尽量减少Mg2+的损失 纯碱(或Na2CO3) MgCO3+H2O![]() Mg(OH)2↓+CO2↑
Mg(OH)2↓+CO2↑
【解析】
为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO。
(1)步骤②是为了将Fe2+氧化成Fe3+,并在控制合适的pH条件时生成Fe(OH)3沉淀而除之.虽然漂液和H2O2都可采用,但对比表2提供的原料价格可以看出,漂液比H2O2的价格低得多,所以选漂液最合理;
(2)步骤③的目的在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去,应加入NaOH,如加入纯碱,不能达到较高的PH,且易生成碳酸镁沉淀,分析表1提供的数据:除去杂质离子合理的pH范围是3.7<pH<9.8,在此范围内,如果pH过高,就会有大量的Mg2+生成Mg(OH)2而进入沉淀中,从而导致生产成本的提高.为了兼顾产品质量和生产成本,选择pH=9.8最合理,当然此时Mg2+也会部分生成Mg(OH)2沉淀,但由于卤块价格低廉,这点不可避免的损失还是可以承受的,以此保证产品的纯度值得;
(3)步骤④的目的是将Mg2+从溶液中沉淀出来.从MgCl2制得MgO,有两种可行的方法,一种是向溶液中加入烧碱,另一种方法是向溶液中加入纯碱,此处选用后一种方法更合理.一方面,加烧碱生成的中间产物Mg(OH)2是胶状沉淀,会造成过滤困难,更重要的是反应过程中不能进行轻化处理,只能得到重质氧化镁;加纯碱生成的中间产物MgCO3呈粗颗粒状,易过滤,MgCO3在水中经一段时间的加热会有部分反应生成CO2,由于CO2气体的产生,使沉淀变得疏松,灼烧沉淀后得到的是轻质氧化镁.另一方面,对比表2中烧碱和纯碱的价格可以看出,纯碱比烧碱价格低得多,采用纯碱路线既合理又经济;
(4)步骤⑤中反应的化学方程式为:MgCO3+H2O![]() Mg(OH)2↓+CO2↑。
Mg(OH)2↓+CO2↑。


科目:高中化学 来源: 题型:
【题目】X、Y、Z是周期表中相邻的三元素,X和Y同周期,Y和Z同主族,三原子的最外层电子数之和为14,质子数之和为28,则三元素为( )
A.N、P、OB.N、C、SiC.C.B、Mg、AlD.C、N、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中含有的杂质(括号内为杂质),可以用加热的方法除去的是( )
A.CaCO3(CaO)B.Cu(CuO)
C.Na2CO3(NaHCO3)D.NaHCO3(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d 为两个电极。下列有关的判断不正确的

A. c 为负极,发生氧化反应
B. 电池工作的过程中,d 电极上产生气泡
C. 电池工作时,溶液中 SO42-向 d 移动
D. 电池工作的过程中,溶液中 SO42-浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A.V3>V2>V1B.V3=V2=V1 C.V1=V2>V3 D.V3>V2=V1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图是氢氧燃料电池构造示意图。
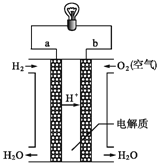
写出氢氧燃料电池的电极反应式:
负极:______________________________,正极:__________________________________。
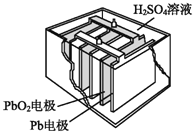
(2)汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O。写出正极的电极反应式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)假设元素周期表可以发展到第八周期,而且电子仍按照构造原理填入能级,第八周期应为_____种元素。
(2)已知N-N、N=N和N≡N键能之比为1.00:2.17:4.90,而C-C、C=C、C≡C键能之比为1.00:1.77:2.34.如何用这些数据理解氮分子不容易发生加成反应而乙炔容易发生加成反应?___
(3)下图是两种具有相同分子式的有机物——邻羟基苯甲酸和对羟基苯甲酸的结构简式。已知它的沸点相差很大,其中对羟基苯甲酸沸点较高,如何从氢键的角度来解释?_______
邻羟基苯甲酸 对羟基苯甲酸
对羟基苯甲酸
(4)离子晶体如食盐,很脆,经不起锤击;原子晶体如石英,同样很脆,也经不起锤击。然而食盐和石英的摩氏硬度却相差极大,应如何解释?____________________________________
(5)如图依次是金属钠、金属锌、碘、金刚石晶胞的示意图,

i:上图的碘晶体中碘分子的排列有____种不同取向,晶胞平均含_______个原子。
ii:金属锌晶胞参数依次为:a=266.49 pm,b=266.49 pm,c=494.68 pm,α=90°,β=90°,γ=120°,则该晶胞的底面积为 ___________cm2.。(只列式不计算)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com