
【题目】下列物质中含有的杂质(括号内为杂质),可以用加热的方法除去的是( )
A.CaCO3(CaO)B.Cu(CuO)
C.Na2CO3(NaHCO3)D.NaHCO3(Na2CO3)
科目:高中化学 来源: 题型:
【题目】已知:2Fe3++SO32-+H2O![]() 2Fe2++SO42-+2H+。如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极。A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是
2Fe2++SO42-+2H+。如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极。A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是

A.G的指针指向B极
B.U中阳离子向A极移动
C.一段时间后,化学反应达到平衡状态,导线中无电流通过
D.一段时间后,B中溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA和2molB在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(s)+B(g)2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:①用物质A表示的反应的平均速率为0.3mol·L-1·s-1②用物质B表示的反应的平均速率为0.6mol·L-1·s-1③2s时物质A的转化率为30%④2s时物质B的浓度为0.7mol·L-1其中正确的是( )
A. ①③B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以铬铁矿(主要成分为亚铬酸亚铁FeCr2O4,还有Al2O3、SiO2等杂质)为主要原料生产红矾钠(Na2Cr2O7),某实验小组模拟其流程如下图所示:
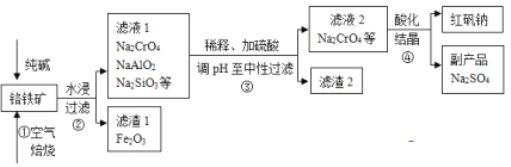
(1)步骤①中,焙烧时所用的仪器材质应选用_________(填“瓷质”、“铁质”或“石英质”),选用该材质的原因是(结合化学方程式解释): _____________________________________________。
(2)配平步骤①中主要反应:
____FeCr2O4+___O2+___Na2CO3![]() ___Fe2O3+___Na2CrO4+___CO2 _____________
___Fe2O3+___Na2CrO4+___CO2 _____________
(3)操作④中,酸化时,CrO42- (黄色)转化为Cr2O72-(橙色),写出平衡转化的离子方程式:____________________________________________________________。用红矾钠溶液进行下列实验:
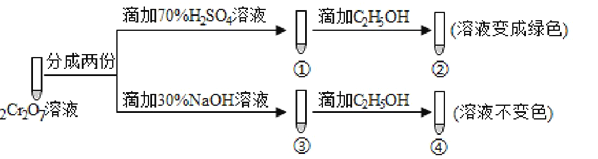
实验过程中,①中溶液橙色加深,③中溶液变黄,对比②和④可得出结论:___________________。
(4)步骤③用硫酸将溶液的pH调至中性,所得滤渣的主要成分是__________、____________;
(5)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得固态副产品Na2SO4的实验操作方法为____________、___________。

(6)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如上,若不考虑气体的溶解,当收集到H213.44L(标准状况下)时有 ____________mol Cr2O72-被还原,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=_________。(已知Ksp[Fe(OH)3]=4.0×10-38mol·L-1,Ksp[Cr(OH)3]=6.0×10-31mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
I.将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)能使化学反应速率加快的措施有________(填序号)。
①升高反应温度②增加C的物质的量③密闭定容容器中充入CO(g)
II.工业上用CO生产燃料甲醇,一定条件下发生反应CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
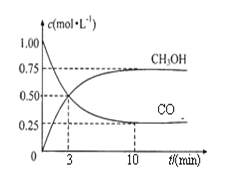
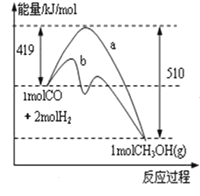
图1 图2
(2)图1是表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=__________________;
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。请结合图像解释催化剂加快化学反应速率的原因_______________________________,该反应消耗1molCO时,______(填“放出”或“吸收”)__________KJ热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
|
|
|
|
根据以上规律判断,下列结论正确的是( )
A. 反应Ⅰ:ΔH>0,P2>P1 B. 反应Ⅱ:ΔH<0,T1<T2
C. 反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 D. 反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
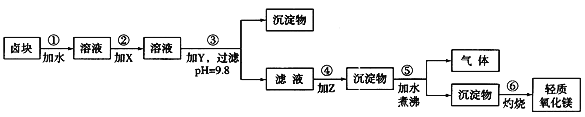
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6﹡ |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去
表2 原料价格表
物质 | 价格/(元·吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
(1)在步骤②中加入的试剂X,最佳的选择是____________,其作用是_________________;
(2)在步骤③中加入的试剂应是_______________________;之所以要控制pH=9.8,其目的是___________________________________________________________。
(3)在步骤④中加入的试剂Z应是________________;/p>
(4)在步骤⑤中发生反应的化学方程式是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 1.86 | 1.10 | 0.99 | 1.52 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1)⑥的单质在空气中加热,生成物的电子式为_______________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___________。
(3)比较①和⑦的氢化物的稳定性(用化学式表示)_______________________________。
(4)写出实验室制备⑤的单质的离子方程式:________________________________。
(5)写出⑧的单质跟③的最高价氧化物的水化物的溶液反应的离子方程式:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com