
【题目】工业上常以铬铁矿(主要成分为亚铬酸亚铁FeCr2O4,还有Al2O3、SiO2等杂质)为主要原料生产红矾钠(Na2Cr2O7),某实验小组模拟其流程如下图所示:
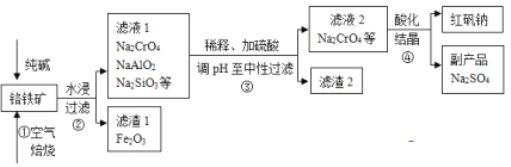
(1)步骤①中,焙烧时所用的仪器材质应选用_________(填“瓷质”、“铁质”或“石英质”),选用该材质的原因是(结合化学方程式解释): _____________________________________________。
(2)配平步骤①中主要反应:
____FeCr2O4+___O2+___Na2CO3![]() ___Fe2O3+___Na2CrO4+___CO2 _____________
___Fe2O3+___Na2CrO4+___CO2 _____________
(3)操作④中,酸化时,CrO42- (黄色)转化为Cr2O72-(橙色),写出平衡转化的离子方程式:____________________________________________________________。用红矾钠溶液进行下列实验:
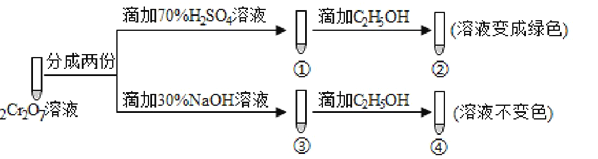
实验过程中,①中溶液橙色加深,③中溶液变黄,对比②和④可得出结论:___________________。
(4)步骤③用硫酸将溶液的pH调至中性,所得滤渣的主要成分是__________、____________;
(5)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得固态副产品Na2SO4的实验操作方法为____________、___________。

(6)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如上,若不考虑气体的溶解,当收集到H213.44L(标准状况下)时有 ____________mol Cr2O72-被还原,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=_________。(已知Ksp[Fe(OH)3]=4.0×10-38mol·L-1,Ksp[Cr(OH)3]=6.0×10-31mol·L-1)
【答案】铁质 Na2CO3+SiO2![]() Na2SiO3+CO2↑ 4 7 8 2 8 8 2CrO42-+2H+Cr2O72-+H2O 红矾钠酸性溶液 氧化性强 H2SiO3(H4SiO4或SiO2·H2O) Al(OH)3 加热浓缩 趁热过滤 0.1 mol 2.0×10-12mol·L-1
Na2SiO3+CO2↑ 4 7 8 2 8 8 2CrO42-+2H+Cr2O72-+H2O 红矾钠酸性溶液 氧化性强 H2SiO3(H4SiO4或SiO2·H2O) Al(OH)3 加热浓缩 趁热过滤 0.1 mol 2.0×10-12mol·L-1
【解析】
(1)焙烧时,加入纯碱,Na2CO3在高温下与SiO2发生反应,瓷质、石英成分是SiO2,因此焙烧时应选用铁质,SiO2与Na2CO3反应的方程式为Na2CO3+SiO2![]() Na2SiO3+CO2;
Na2SiO3+CO2;
(2)FeCr2O4中Fe显+2价,Cr显+3价,根据反应方程式为,Fe元素的化合价由+2价→+3价,升高1价,Cr元素的化合价由+3价→+6价,Cr整体升高6价,FeCr2O4整体升高7价,O2中O的化合价降低,整体降低4价,最小公倍数为28,根据原子守恒配平其他,反应方程式为4FeCr2O4+7O2+8Na2CO3=2Fe2O3+8Na2CrO4+8CO2;
(3)CrO42-溶液中存在:2CrO42-+2H+![]() Cr2O72-+H2O,酸化,加入H+,c(H+)增大,平衡向正反应方向进行,溶液颜色由黄色转化为橙色;①:加入硫酸,促使平衡向正反应方向进行,①中滴加C2H5OH,溶液变成绿色,Cr元素以Cr3+形式存在,发生氧化还原反应;红钒钠溶液中加入NaOH,使平衡向逆反应方向进行,滴加C2H5OH溶液,溶液不变色,没有发生氧化还原反应,对比实验得出结论是红钒钠在酸性条件下具有强氧化性;
Cr2O72-+H2O,酸化,加入H+,c(H+)增大,平衡向正反应方向进行,溶液颜色由黄色转化为橙色;①:加入硫酸,促使平衡向正反应方向进行,①中滴加C2H5OH,溶液变成绿色,Cr元素以Cr3+形式存在,发生氧化还原反应;红钒钠溶液中加入NaOH,使平衡向逆反应方向进行,滴加C2H5OH溶液,溶液不变色,没有发生氧化还原反应,对比实验得出结论是红钒钠在酸性条件下具有强氧化性;
(4)根据流程图,反应③除去Al、Si等元素,银此滤液1中加入硫酸发生AlO2-+H++H2O=Al(OH)3↓,SiO32-+2H+=H2SiO3↓,滤渣成分是H2SiO3和Al(OH)3;
(5)得到Na2SO4,根据图像,Na2SO4的溶解度随着温度的升高而降低,得到Na2SO4的操作方法是蒸发浓缩、冷却结晶;
(6)根据装置图,B电极反应式为2H++2e-=H2↑,A电极反应式为Fe-2e-=Fe2+,建立:H2~Fe2+,n(Fe2+)=13.44/22.4mol=0.6mol,根据得失电子数目守恒,n(Fe2+)×1=n(Cr2O72-)×2×3,解得n(Cr2O72-)=0.1mol,同时产生Fe(OH)3和Cr(OH)3沉淀,则溶液中有c(Fe3+)/c(Cr3+)=Ksp[Fe(OH)3]/Ksp[Cr(OH)3],代入数值,得出:c(Fe3+)=2.0×10-12mol·L-1。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 为短周期主族元素,其原子序数依次增大;B、C、D、E 位于同一周期; A 的简单气态氢化物可以用作制冷剂;1 mol B 单质与足量盐酸反应生成气体在标准状况下的体积为33.6 L;D 原子最外层电子数与核外电子总数之比为 3∶8;C 的原子子序数是 A 的两倍。
(1)A、B 简单离子半径由大到小的顺序为______________ (填离子符号) 。
(2)C 在元素周期表中的位置是_______________ 。
(3)A 的简单气态氢化物接触到 E 的简单气态氢化物时可观察到的现象是_____________。
(4) D 与 E 可形成原子个数比为 1∶2 的化合物,其电子式为________。
(5)C、D、E 最简单气态氢化物稳定性由高到低的顺序是___________ (用化学式表达 )。
(6)B 与 D 形成的化合物遇水迅速水解,写出该反应的化学方程式_______________________。
(7)若 E 单质与 NaOH 溶液反应生成 NaE、NaEO 和 NaEO3,则 30mL 2mol/LNaOH 与_____mol E 单质恰好完全反应(忽略 E 单质与水的反应及盐类的水解反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食中的钠主要存在于食盐中,它是烹饪中重要的调味品,也是保证肌体水分平衡的最重要物质。钠缺乏症可造成生长缓慢、食欲减退。由于失水体重减轻、肌肉痉挛、恶心、腹泻和头痛。膳食中长期摄入过多的钠将导致高血压。这里涉及到的钠指的是( )
A.钠单质B.食盐C.钠离子D.碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol·L-1的两种气体X2和Y2在密闭容器中反应,经过tmin后,测得物质的浓度分别为:c(X2)=0.4mol·L-1,c(Y2)=0.8mol·L-1,则该反应的方程式可表示为()
A. X2+2Y2![]() 2XY2B. 2X2+Y2
2XY2B. 2X2+Y2![]() 2X2Y
2X2Y
C. X2+3Y2![]() 2XY3D. 3X2+Y2
2XY3D. 3X2+Y2![]() 2X3Y
2X3Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中含有的杂质(括号内为杂质),可以用加热的方法除去的是( )
A.CaCO3(CaO)B.Cu(CuO)
C.Na2CO3(NaHCO3)D.NaHCO3(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的晶体,按其熔点由低到高的排列顺序正确的是( )
A.NaCl、SiO2、CO2B.CO2、NaCl、SiO2
C.SiO2、MgO、NaClD.MgO、NaCl、SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯。在实验室我们可以用如图所示的装置来制取乙酸乙酯。回答下列问题:
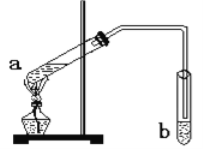
(1)写出试管a中发生的化学方程式:_____________________________________;
(2)试管b中的导管要在液面的稍上方,不能插入液面以下,其目的是 ________________;
(3)浓硫酸的作用为___________________________________________________;
(4)试管b中所盛的溶液为________________,其主要作用是 _________________________。
(5)分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行:
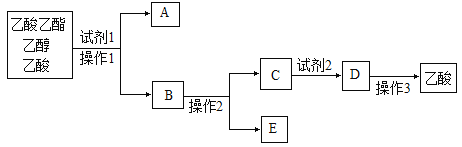
①试剂1最好选用_________________,
②操作1是________________,所用的主要仪器名称是_______________;
③操作2是_____________,试剂2最好选用_______________,操作3是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com