
【题目】膳食中的钠主要存在于食盐中,它是烹饪中重要的调味品,也是保证肌体水分平衡的最重要物质。钠缺乏症可造成生长缓慢、食欲减退。由于失水体重减轻、肌肉痉挛、恶心、腹泻和头痛。膳食中长期摄入过多的钠将导致高血压。这里涉及到的钠指的是( )
A.钠单质B.食盐C.钠离子D.碳酸氢钠
科目:高中化学 来源: 题型:
【题目】关于NaHCO3性质的有关叙述正确的是( )
A. 只能与强酸反应,不能与强碱反应
B. 医疗上可用于治疗胃酸过多
C. 与足量的酸反应时放出的CO2比等质量的Na2CO3要少
D. 同温度时,NaHCO3的溶解度>Na2CO3的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于周期表的说法正确的是( )
A.同一周期元素原子的最外层电子数相同
B.同一主族元素原子的电子层数相同
C.能生成碱的金属都在第ⅠA族
D.第三周期有8种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe3++SO32-+H2O![]() 2Fe2++SO42-+2H+。如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极。A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是
2Fe2++SO42-+2H+。如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极。A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是

A.G的指针指向B极
B.U中阳离子向A极移动
C.一段时间后,化学反应达到平衡状态,导线中无电流通过
D.一段时间后,B中溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA和2molB在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(s)+B(g)2C(g),若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:①用物质A表示的反应的平均速率为0.3mol·L-1·s-1②用物质B表示的反应的平均速率为0.6mol·L-1·s-1③2s时物质A的转化率为30%④2s时物质B的浓度为0.7mol·L-1其中正确的是( )
A. ①③B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以铬铁矿(主要成分为亚铬酸亚铁FeCr2O4,还有Al2O3、SiO2等杂质)为主要原料生产红矾钠(Na2Cr2O7),某实验小组模拟其流程如下图所示:
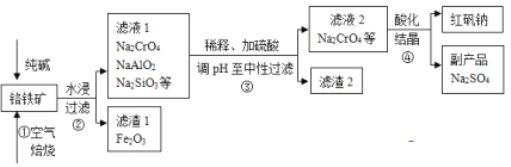
(1)步骤①中,焙烧时所用的仪器材质应选用_________(填“瓷质”、“铁质”或“石英质”),选用该材质的原因是(结合化学方程式解释): _____________________________________________。
(2)配平步骤①中主要反应:
____FeCr2O4+___O2+___Na2CO3![]() ___Fe2O3+___Na2CrO4+___CO2 _____________
___Fe2O3+___Na2CrO4+___CO2 _____________
(3)操作④中,酸化时,CrO42- (黄色)转化为Cr2O72-(橙色),写出平衡转化的离子方程式:____________________________________________________________。用红矾钠溶液进行下列实验:
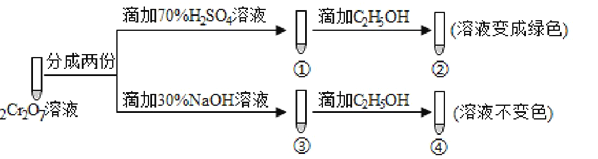
实验过程中,①中溶液橙色加深,③中溶液变黄,对比②和④可得出结论:___________________。
(4)步骤③用硫酸将溶液的pH调至中性,所得滤渣的主要成分是__________、____________;
(5)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得固态副产品Na2SO4的实验操作方法为____________、___________。

(6)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理示意图如上,若不考虑气体的溶解,当收集到H213.44L(标准状况下)时有 ____________mol Cr2O72-被还原,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=_________。(已知Ksp[Fe(OH)3]=4.0×10-38mol·L-1,Ksp[Cr(OH)3]=6.0×10-31mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
|
|
|
|
根据以上规律判断,下列结论正确的是( )
A. 反应Ⅰ:ΔH>0,P2>P1 B. 反应Ⅱ:ΔH<0,T1<T2
C. 反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 D. 反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com