
����Ŀ������8��Ԫ�ص����ʡ��������±����У��������ڵڶ���������ڡ�
�� | �� | �� | �� | �� | �� | �� | �� | |
ԭ�Ӱ뾶(10��10m) | 0.74 | 1.60 | 1.86 | 1.10 | 0.99 | 1.52 | 0.75 | 1.43 |
�����ͻ��ϼ� | ��2 | ��1 | ��5 | ��7 | ��1 | ��5 | ��3 | |
��2 | ��3 | ��1 | ��3 |
�ش��������⣺
��1���ĵ����ڿ����м��ȣ�������ĵ���ʽΪ_______________��
��2��������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ��___________��
��3���ȽϢٺ͢ߵ��⻯����ȶ��ԣ��û�ѧʽ��ʾ��_______________________________��
��4��д��ʵ�����Ʊ��ݵĵ��ʵ����ӷ���ʽ��________________________________��
��5��д����ĵ��ʸ��۵�����������ˮ�������Һ��Ӧ�����ӷ���ʽ��___________________________��
���𰸡�![]() HClO4 H2O>NH3 MnO2+4H++2Cl��
HClO4 H2O>NH3 MnO2+4H++2Cl��![]() Mn2++Cl2��+2H2O 2Al+2OH��+2H2O=2AlO2��+3H2��
Mn2++Cl2��+2H2O 2Al+2OH��+2H2O=2AlO2��+3H2��
��������
��û����ۡ�ֻ����ͼ�-2������֪��ΪO���ۢ������+1�����ڢ�A�壬�Ң۵�ԭ�Ӱ뾶�ϴ�ԭ�Ӱ뾶������С���ʢ�ΪLi����ΪNa���������+2�����ڢ�A�壬ԭ�Ӱ뾶����Li���ʢ�ΪMg���ܢ߶������+5����ͼ�-3�����ڢ�A�壬�Ңܵ�ԭ�Ӱ뾶�ϴʢ�ΪP����ΪN���������+7����ͼ�-1�����ΪCl����ֻ�����+3�����ڢ�A�壬ԭ�Ӱ뾶����P���ʢ�ΪAl���ݴ˽��
��û����ۡ�ֻ����ͼ�-2������֪��ΪO���ۢ������+1�����ڢ�A�壬�Ң۵�ԭ�Ӱ뾶�ϴ�ԭ�Ӱ뾶������С���ʢ�ΪLi����ΪNa���������+2�����ڢ�A�壬ԭ�Ӱ뾶����Li���ʢ�ΪMg���ܢ߶������+5����ͼ�-3�����ڢ�A�壬�Ңܵ�ԭ�Ӱ뾶�ϴʢ�ΪP����ΪN���������+7����ͼ�-1�����ΪCl����ֻ�����+3�����ڢ�A�壬ԭ�Ӱ뾶����P���ʢ�ΪAl��
(1)��ΪLiԪ�أ�����Li�ڿ����м���ֻ������Li2O�������ӻ���������ʽΪ![]() ��
��
(2)Ԫ�صķǽ�����Խǿ��������������ˮ���������Խǿ���ڢ�~~������Ԫ����������ۣ�����Ԫ������Ԫ�طǽ�������ǿ��������������ˮ�����У�������ǿ�Ļ�����ķ���ʽ��HClO4��
(3)��ΪOԪ�أ���ΪNԪ�أ��ǽ�����O����N�����⻯����ȶ���H2O>NH3��
(4)��Ϊ��Ԫ�أ�ʵ��������MnO2��Ũ�����ϼ�����������������Ӧ�����ӷ���ʽΪMnO2+4H++2Cl��![]() Mn2++Cl2��+2H2O��
Mn2++Cl2��+2H2O��
(5)��ΪAl����ΪNa��Al����NaOH��Һ����NaAlO2��H2�������ķ�Ӧ�����ӷ���ʽΪ2Al+2OH��+2H2O=2AlO2��+3H2����


 ���ĺ����Ͼ�������ϵ�д�
���ĺ����Ͼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������к��е����ʣ�������Ϊ���ʣ��������ü��ȵķ�����ȥ���ǣ� ��
A.CaCO3��CaO��B.Cu��CuO��
C.Na2CO3��NaHCO3��D.NaHCO3��Na2CO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���е��������pH��Ba(OH)2��NaOH��NH3��H2O���ּ���Һ���μӵ�Ũ�ȵ����Ὣ����ǡ���кͣ���ȥ�������ֱ�ΪV1��V2��V3�������ߵĴ�С��ϵ��ȷ����
A.V3>V2>V1B.V3=V2=V1��C.V1=V2>V3����D.V3>V2=V1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ������ȼ�ϵ�ع���ʾ��ͼ��
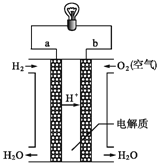
д������ȼ�ϵ�صĵ缫��Ӧʽ��
������______________________________��������__________________________________��
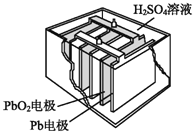
��2��������������Դ����Ǧ���ء���ṹ��ͼ��ʾ���ŵ�ʱ�ĵ�ط�Ӧ���£�PbO2+Pb+2H2SO4=2PbSO4+2H2O��д�������ĵ缫��Ӧʽ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������dzµ��㡱������Ϊ���ڴ������������������ζ��������������ʵ�������ǿ�������ͼ��ʾ��װ������ȡ�����������ش��������⣺
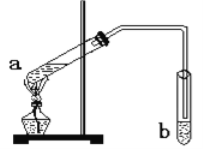
��1��д���Թ�a�з����Ļ�ѧ����ʽ��_____________________________________��
��2���Թ�b�еĵ���Ҫ��Һ������Ϸ������ܲ���Һ�����£���Ŀ���� ________________��
��3��Ũ���������Ϊ___________________________________________________��
��4���Թ�b����ʢ����ҺΪ________________������Ҫ������ _________________________��
��5�����������������Ҵ�������Ļ����ɰ����в�����У�
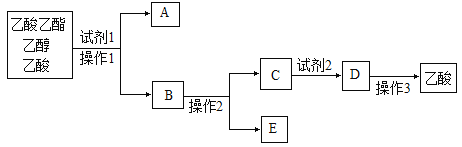
���Լ�1���ѡ��_________________��
�ڲ���1��________________�����õ���Ҫ����������_______________��
�۲���2��_____________���Լ�2���ѡ��_______________������3��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȫ�ӳɺ�����������2��2��3-�������������
A. (CH3)3 C��CH=CH2B. CH2=C(CH2CH3)C (CH3)3
C. HC��CCH(CH3)C(CH3)3D. (CH3)3CC(CH3)=CHCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.Ԫ�����ڱ�����7�����壬7�����壬��14������
B.��Ԫ��λ�ڵڶ����ڵ�������
C.��������ǿ��Ԫ����Li
D.�ǽ�������ǿ��Ԫ����F
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������Ԫ�����ڱ����Է�չ���ڰ����ڣ����ҵ������չ���ԭ�������ܼ����ڰ�����ӦΪ_____��Ԫ�ء�
��2����֪N-N��N=N��N��N����֮��Ϊ1.00:2.17:4.90,��C-C��C=C��C��C����֮��Ϊ1.00:1.77:2.34.�������Щ����������Ӳ��������ӳɷ�Ӧ����Ȳ�������ӳɷ�Ӧ?___
��3����ͼ�����־�����ͬ����ʽ���л�������ǻ�������Ͷ��ǻ�������Ľṹ��ʽ����֪���ķе����ܴ����ж��ǻ�������е�ϸߣ���δ�����ĽǶ������ͣ�_______
���ǻ������� ���ǻ�������
���ǻ�������
��4�����Ӿ�����ʳ�Σ��ܴ࣬��������ԭ�Ӿ�����ʯӢ��ͬ���ܴ࣬Ҳ��������Ȼ��ʳ�κ�ʯӢ��Ħ��Ӳ��ȴ����Ӧ��ν��ͣ�____________________________________
��5����ͼ�����ǽ����ơ�����п���⡢���ʯ������ʾ��ͼ��

i����ͼ�ĵ⾧���е���ӵ�������____�ֲ�ͬȡ����ƽ����_______��ԭ�ӡ�
ii������п������������Ϊ��a=266.49 pm��b=266.49 pm��c=494.68 pm����=90��,��=90�㣬��=120�㣬��þ����ĵ����Ϊ ___________cm2.����ֻ��ʽ�����㣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ��ͼ��ʾ������������ͷ�Ӧ��������ȥ����D��F��G��H��Ϊ�������壬����D��ʹʪ��ĺ�ɫʯ����ֽ������G�ʻ���ɫ��H�ڿ����к�����ߣ�C��Ħ������Ϊ32g��mol��1��EΪ�����Լ
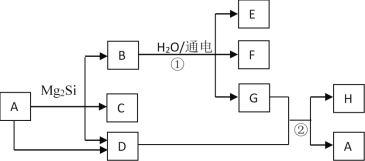
��1��C�Ļ�ѧʽΪ_________��
��2��A�ĵ���ʽΪ_________��
��3��д����Ӧ�ٵ����ӷ���ʽ_______________��
��4��д����Ӧ�ڵĻ�ѧ����ʽ________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com